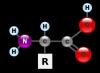
Аминокислоты - главный строительный материал любого живого организма. По своей природе они являются первичными азотистыми веществами растений, которые синтезируются из почвы. Строение и и аминокислот зависят от их состава.
Структура аминокислоты
Каждая ее молекула имеет карбоксильные и аминные группы, которые соединены с радикалом. Если аминокислота содержит 1 карбоксильную и 1 амино-группу, строение ее можно обозначить формулой, представленной ниже.

Аминокислоты, которые имеют 1 кислотную и 1 щелочную группу, называют моноаминомонокарбоновыми. В организмах также синтезируются и функции которых обусловливают 2 карбоксильных группы или 2 аминных группы. Аминокислоты, содержащие 2 карбоксильные и 1 аминную группы, называют моноаминодикарбоновыми, а имеющие 2 аминные и 1 карбоксильную - диаминомонокарбоновыми.
Также они различны по строению органического радикала R. У каждой из них имеется свое наименование и структура. Отсюда и различные функции аминокислот. Именно наличие кислотной и щелочной групп обеспечивает ее высокую реактивность. Эти группы соединяют аминокислоты и образуют полимер - белок. Белки еще именуются полипептидами из-за своего строения.
Аминокислоты как строительный материал
Молекула белка - это цепочка из десятков или сотен аминокислот. Белки отличаются по составу, количеству и порядку расположения аминокислот, ведь число сочетаний из 20 составляющих практически бесконечно. Одни из них имеют весь состав незаменимых аминокислот, иные обходятся без одной или нескольких. Отдельные аминокислоты, структура, функции которых подобны белкам человеческого тела, не применяются в качестве пищевых, так как малорастворимы и не расщепляются ЖКТ. К таким принадлежат белки ногтей, волос, шерсти или перьев.
Функции аминокислот трудно переоценить. Эти вещества выступают главной пищей в рационе людей. Какую функцию выполняют аминокислоты? Они увеличивают рост мышечной массы, помогают укреплению суставов и связок, восстанавливают поврежденные ткани организма и участвуют во всех процессах, происходящих в теле человека.

Незаменимые аминокислоты
Только из добавок или пищевых продуктов можно получить Функции в процессе формирования здоровых суставов, крепких мышц, красивых волос очень значимы. К таким аминокислотам относятся:
- фенилаланин;
- лизин;
- треонин;
- метионин;
- валин;
- лейцин;
- триптофан;
- гистидин;
- изолейцин.
Функции аминокислот незаменимых
Эти кирпичики выполняют важнейшие функции в работе каждой клетки человеческого организма. Они незаметны, пока поступают в организм в достаточном количестве, но их недостаток существенно ухудшает работу всего организма.
- Валин возобновляет мышцы, служит отличным источником энергии.
- Гистидин улучшает состав крови, способствует восстановлению и росту мышц, улучшает работу суставов.
- Изолейцин помогает выработке гемоглобина. Контролирует количество сахара в крови, повышает энергичность человека, выносливость.
- Лейцин укрепляет иммунитет, следит за уровнем сахара и лейкоцитов в крови. Если уровень лейкоцитов завышен: он их понижает и подключает резервы организма для ликвидации воспаления.
- Лизин помогает усвоению кальция, что формирует и укрепляет кости. Помогает выработке коллагена, улучшает структуру волос. Для мужчин это отличный анаболик, так как он наращивает мышцы и увеличивает мужскую силу.
- Метионин нормализует работу пищеварительной системы и печени. Участвует в расщеплении жиров, убирает токсикоз у беременных, благотворно влияет на волосы.
- Треонин улучшает работу ЖКТ. Повышает иммунитет, участвует в создании эластина и коллагена. Треонин препятствует отложению жира в печени.
- Триптофан отвечает за эмоции человека. Вырабатывает серотонин - гормон счастья, тем самым нормализует сон, поднимает настроение. Укрощает аппетит, благотворительно влияет на сердечную мышцу и артерии.
- Фенилаланин служит передатчиком сигналов от нервных клеток в мозг головы. Улучшает настроение, подавляет нездоровый аппетит, улучшает память, повышает восприимчивость, снижает боль.
Дефицит незаменимых аминокислот приводит к остановке роста, нарушению обмена веществ, снижению мышечной массы.

Заменимые аминокислоты
Это такие аминокислоты, строение и функции которых вырабатываются в организме:
- аргинин;
- аланин;
- аспарагин;
- глицин;
- пролин;
- таурин;
- тирозин;
- глутамат;
- серин;
- глутамин;
- орнитин;
- цистеин;
- карнитин.
Функции аминокислот заменимых
- Цистеин ликвидирует токсические вещества, участвует в создании тканей кожи и мышц, представляет собой естественный антиоксидант.
- Тирозин снижает физическую усталость, ускоряет метаболизм, ликвидирует стресс и депрессию.
- Аланин служит для роста мускулатуры, является источником энергии.
- увеличивает метаболизм и снижает образование аммиака при больших нагрузках.
- Цистин устраняет боль при травмировании связок и суставов.
- отвечает за мозговую активность, во время длительных физических нагрузок переходит в глюкозу, вырабатывая энергию.
- Глутамин восстанавливает мышцы, повышает иммунитет, ускоряет метаболизм, усиливает работу мозга и создает гормон роста.
- Глицин необходим для работы мышц, расщепления жира, стабилизации артериального давления и сахара в крови.
- Карнитин перемещает жировые кислоты в клетки, где совершается их расщепление с выделением энергии, в результате чего сжигается лишний жир и генерируется энергия.
- Орнитин производит гормон роста, участвует в процессе мочеобразования, расщепляет жирные кислоты, помогает выработке инсулина.
- Пролин обеспечивает производство коллагена, он необходим для связок и суставов.
- Серин повышает иммунитет и вырабатывает энергию, нужен для быстрого метаболизма жирных кислот и роста мышц.
- Таурин расщепляет жир, поднимает сопротивляемость организма, синтезирует желчные соли.
Белок и его свойства
Белки, или протеины - высокомолекулярные соединения с содержанием азота. Понятие "протеин", впервые обозначенное Берцелиусом в 1838 г., происходит от греческого слова и означает "первичный", что отображает лидирующее значение протеинов в природе. Разновидность белков дает возможность для существования огромного количества живых существ: от бактерий до человеческого организма. Их существенно больше, чем других макромолекул, ведь белки - это фундамент живой клетки. Составляют приблизительно 20% от массы человеческого тела, больше 50% сухой массы клетки. Такое количество разнообразных белков объясняется свойствами двадцати различных аминокислот, которые взаимодействуют друг с другом и создают полимерные молекулы.

Выдающееся свойство белков - способность к самостоятельному созданию определенной, свойственной конкретному белку пространственной структуры. По белки - это биополимеры с пептидными связями. Для химического состава белков свойственно постоянное среднее содержание азота - приблизительно 16%.
Жизнь, а также рост и развитие организма невозможны без функции белковых аминокислот строить новые клетки. Белки нельзя заменить прочими элементами, их роль в человеческом организме является чрезвычайно важной.
Функции белков
Необходимость белков заключается в таких функциях:
- он необходим для роста и развития, так как выступает главным строительным материалом для создания новых клеток;
- управляет метаболизмом, во время которого освобождается энергия. После принятия пищи скорость метаболизма увеличивается, например, если еда состоит из углеводов, метаболизм ускоряется на 4%, если из белков - на 30%;
- регулируют в организме, благодаря своей гидрофильности - способности притягивать воду;
- усиливают работу иммунной системы, синтезируя антитела, которые защищают от инфекции и ликвидируют угрозу заболевания.

Продукты - источники белков
Мышцы и скелет человека состоят из живых тканей, которые на протяжении жизни не только функционируют, но и обновляются. Восстанавливаются после повреждений, сохраняют свою силу и прочность. Для этого им требуются вполне определенные питательные вещества. Пища обеспечивает организм энергией, необходимой для всех процессов, включая работу мышц, рост и восстановление тканей. А белок в организме используется и как источник энергии, и как стройматериал.

Поэтому очень важно соблюдать его ежедневное использование в пищу. Богатые белком продукты: курица, индейка, постная ветчина, свинина, говядина, рыба, креветки, фасоль, чечевица, бекон, яйца, орех. Все эти продукты обеспечивают организм белком и дают энергию, необходимую для жизни.
1.Аминокислоты проявляют амфотерные свойства и кислот и аминов, а также специфические свойства, обусловленные совместным присутствием указанных групп. В водных растворах АМК существуют в виде внутренних солей (биполярных ионов). Водные растворы моноаминомонокарбоновых кислот на лакмус нейтральны, т.к. в их молекулах содержится равное число -NН 2 - и -СООН групп. Эти группы взаимодействуют между собой с образованием внутренних солей:
Такая молекула имеет в двух местах противоположные заряды: положительный NН 3 + и отрицательный на карбоксиле –СОО - . В связи с этим внутренняя соль АМК имеет название биполярного иона или Цвиттер–иона (Zwitter – гибрид).
Биполярный ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы; в щелочной среде – как анион. Существуют значения рН специфические для каждой аминокислоты, в которой количество анионных форм в растворе равно количеству катионных форм. Значение рН при котором общий заряд молекулы АМК равен 0, называется изоэлектрической точкой АМК (pI АК).
Водные растворы моноаминодикарбоновых кислот обладают кислой реакцией среды:
HООС-СH 2 -СH-СOOH « - OOC-CH 2 -CH–COO - + H +
Изоэлектрическая точка моноаминодикарбоновых кислот находится в кислой среде и такие АМК называют кислыми.
Диаминомонокарбоновые кислоты обладают в водных растворах основными свойствами (участие воды в процессе диссоциации показывать обязательно):
NH 2 -(CH 2) 4 -CH-COOH + H 2 O « NH 3 + -(CH 2) 4 -CН–COO - + OH -
Изоэлектрическая точка диаминомонокарбоновых кислот находится в при рН>7 и такие АМК называют основными.
Являясь биполярными ионами, аминокислоты проявляют амфотерные свойства: они способны образовывать соли как с кислотами, так и с основаниями:
Взаимодействие с соляной кислотой HCl приводит к образованию соли:
R-CH-COOH + HCl ® R-CH-COOH
NH 2 NH 3 + Сl -
Взаимодействие с основанием приводит к образованию соли:
R-CH(NH 2)-COOH + NaOH ® R-CH(NH 2)-COONa + H 2 O
2. Образование комплексов с металлами – хелатный комплекс. Строение медной соли гликокола (глицина) можно изобразить следующей формулой:

Почти вся имеющаяся в организме человека медь (100 мг) связана с белками (аминокислотами) в виде этих устойчивых клешневидных соединений.
3. Подобно другим кислотам аминокислоты образуют сложные эфиры, галоген ангидриды, амиды.
4. Реакции декарбоксилирования протекают в организме при участии специальных ферментов декарбоксилаз: получающиеся при этом амины (триптамин, гистамин, серотинин) называются биогенными аминами и являются регуляторами ряда физиологических функций человеческого организма.
5. Взаимодействие с формальдегидом (альдегидами)
R-CH-COOH + H 2 C=О ® R-CH-COOH
Формальдегид связывает NН 2 – группу, -СООН группа остается свободной и может быть оттитрована щелочью. Поэтому данная реакция используется для количественного определения аминокислот (метод Сёренсена).
6. Взаимодействие с азотистой кислотой приводит к образованию гидроксикислот и выделению азота. По объему выделившегося азота N 2 определяют его количественное содержание в исследуемом объекте. Эта реакция применяется для количественного определения аминокислот (метод Ван–Слайка):
R-CH-COOH + HNO 2 ® R-CH-COOH + N 2 + H 2 O
Это один из способов дезаминирования АМК вне организма
7. Ацилирование аминокислот. Аминогруппу АМК можно ацилировать хлорангидридами и ангидридами кислот уже при комнатной температуре.
Продуктом записанной реакции является ацетил-α-аминопропионовая кислота.
Ацильные производные АМК широко используются при изучении последовательности их в белках и в синтезе пептидов (защита аминогруппы).
8.Специфические свойства, реакции, связанные с наличием и взаимным влиянием амино- и карбоксильной групп - образование пептидов. Общим свойством a-АМК является процесс поликонденсации , приводящий к образованию пептидов. В результате этой реакции формируются амидные связи по месту взаимодействию карбоксильной группы одной АМК и аминогруппы другой АМК. Другими словами, пептиды – это амиды, образующиеся в результате взаимодействия аминогрупп и карбоксилов аминокислот. Амидная связь в таких соединениях называется пептидной связью (разобрать строение пептидной группы и пептидной связи: трехцентровая р,p-сопряженная система)
В зависимости от числа аминокислотных остатков в молекуле различают ди-, три-, тетрапептиды и т.д. вплоть до полипептидов (до 100 остатков АМК). Олигопептиды содержат от 2 до 10 остатков АМК, белки - более100 остатков АМК.В общем виде полипептидную цепь можно представить схемой:
H 2 N-CH-CO-NH-CH-CO-NH-CH-CO-... -NH-CH-COOH
Где R 1 , R 2 , … R n – радикалы аминокислот.
Понятие о белках.
Наиболее важными биополимерами аминокислот являются белки – протеины. В организме человека насчитывается около 5млн. различных белков, которые входят в состав кожи, мышц, крови и других тканей. Белки (протеины) получили свое название от греческого слова «protos» - первый, важнейший. Белки выполняют ряд важнейших функций в организме: 1. Строительная функция; 2. Транспортная функция; 3. Защитная функция; 4. Каталитическая функция; 5. Гормональная функция; 6. Питательная функция.
Все природные белки образуются из мономеров аминокислот. При гидролизе белков образуется смесь АМК. Этих АМК – 20.
4. Иллюстративный материал: презентация
5. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с. : ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с. : ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
6. Контрольные вопросы (обратная связь):
1. Что преопределяет структуру полипептидной цепи в целом?
2. К чему приводит денатурация белка?
3. Что называют изоэлектрической точкой?
4. Какие аминокислоты называются незаменимыми?
5. Каким же образом белки образуются в нашем организме?
Похожая информация.
Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н 2 N -СН 2 -СООН + HCl → Сl [Н 3 N-СН 2 -СООН],
Н 2 N -СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H 2 N-CH 2 -СООН + Н 3 N -СН 2 -СОO — .
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:

Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH 2), лизин — щелочной (одна группа -СООН, две -NH 2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота - в гидроксикислоту:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка ).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + Н 2 О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот - их способность к конденсации с образованием пептидов.
Качественные реакции .
1) Все аминокислоты окисляются нингидрином

с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос - желтый).
Все -аминокислоты, кроме глицина, содержат хиральный -углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные -аминокислоты обладают одной и той же относительной конфигурацией при -углеродном атоме. -Углеродному атому (-)-серина была условно приписана L -конфигурация, а -углеродному атому (+)-серина - D -конфигурация. При этом, если проекция -аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем -аминокислотам, обладающим хиральным -углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство -аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы , т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при -углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (-NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах - к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.

2. образование амидов по аминогруппе. При ацилировании аминогруппы -аминокислоты образуется амид.

Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:

Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью . Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы - фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
Кислотно-основные свойства аминокислот связаны с наличием в их структуре двух ионизируемых групп-карбоксильной и аминогруппы, поэтому амнокислоты могут проявлять свойства как кислот, так и оснований, т.е. они являются амфотерными соединениями. В кристаллическом состоянии и в водных растворах -аминокислоты существуют в виде биполярных ионов, называемых также цвиттерионами. Ионное строение обуславливает некоторые особенности свойств-аминокислот: высокую температуру плавления (200-300С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. С растворимостью аминокислот в воде связана их всасываемость и транспорт в организме. Ионизация молекул аминокислот зависит от рН раствора. Для моноаминомонокарбоновых кислот процесс диссоциации имеет следующий вид:
В сильно кислых растворах аминокислоты присутствуют в виде положительных ионов, а в щелочных – в виде отрицательных.
Кислотно-основные свойства аминокислот можно объяснить исходя из теории кислот и оснований Бренстеда-Лоури. Полностью протонированная -аминокислота (катионная форма) с позиции теории Бренстеда является двухосновной кислотой, содержащей две кислотные группы:недиссоциированную карбоксильную группу (– СООН) и протонированную аминогруппу (NН 3), которые характеризуются соответствующими значениями рК 1 и рК 2 .
Величины рК для аминокислот определяют по кривым титрования. Рассмотрим кривую титрования аланина (рис. 1).

Рис. 1 – кривые, полученные при титровании 0,1М раствора аланина 0,1М раствором HCl(а) и 0,1М расторомNaOH(б).
Из кривой титрования аланина следует, что карбоксильная группа имеет рК 1 =2,34, а протонированная аминогруппа рК 2 = 9,69. При рН = 6,02 аланин существует в виде биполярного иона, когда суммарный электрический заряд частицы равен 0. При этом значении рН молекула аланина электронейтральна. Такое значение рН называют изоэлектрической точкой и обозначают рН иэт или рI. Для моноаминомонокарбоновых кислот изоэлектрическая точка рассчитывается как среднее арифметическое двух значений рК . Например для аланина она равна:
рI= ½(рК 1 + рК 2) = ½(2,34 + 9,69) = 6,02
При значении рН, превышающем изоэлектрическую точку, аминокислота заряжается отрицательно, а при значении рН ниже рIаминокислота несет суммарный положительный заряд. Например, при рН = 1,0 все молекулы аланина существуют в форме ионов

с суммарным зарядом +1. При рН = 2,34, когда имеется смесь равных количеств ионов

суммарный заряд = +0,5. Аналогичным образом можно предсказать знак и величину суммарного заряда для любой другой аминокислоты при любом значении рН.
Аминокислоты с ионизируемой группой в радикале имеют более сложные кривые титрования, складывающиеся из 3-ох участков, соответствующих трем возможным стадиям ионизации, и, следовательно, они имеют три значения рК (рК 1 , рК 2 и рК R). Ионизация кислых аминокислот, например аспарагиновой, состоит из следующих последовательных стадий:

Изоэлектрические точки таких аминокислот определяются также присутствием ионизируемой группой радикала, наряду с -амино и-карбоксильными группами. Для моноаминодикарбоновых кислот изоэлектрические точки смещены в кислую область рН и определяются как среднее арифметическое между величинами рК для двух карбоксильных групп (рIаспарагиновой кислоты = 2,97). Для основных аминокислот рIсмещены в щелочную область и вычисляются как среднее арифметическое между величинами рК для двух протонированных аминогрупп (рIлизина = 9,74).
Кислотно-основные свойства аминокислот используются для разделения и последующей идентификации аминокислот методами электрофореза и ионообменной хроматографии. Оба эти метода основаны на различиях в знаке и величине суммарного электрического заряда при данном значении рН.