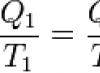Температура Т была введена вначале эмпирическим путем с помощью газового термометра исходя из зависимости между давлением и температурой идеального газа. Но уравнение для идеального газа справедливо в ограниченном интервале значений давлений и температур.
Из выражения для КПД машины, работающей по циклу Карно, следует, что
Вообще говоря, это соотношение позволяет опытным путём ввести новую абсолютную шкалу температур, которая не зависит от свойств рабочего тела и такую, что КПД для цикла Карно будет зависеть только от новых температур, и будет выполняться равенство
Ф (Т Х, Т Н ).
Рассмотрим цикл Карно 1-2-5-6-1 с температурами нагревателя Т 1 и холодильника Т 3 , состоящий из двух «подциклов» 1-2-3-4-1 и 4-3-5-6-4 с промежуточной температурой Т 2 . Цикл 1-2-5-6-1 можно интерпретировать как термодинамический цикл объединённой тепловой машины, состоящей из двух тепловых машин, работающих по круговым процессам 1-2-3-4-1 и 4-3-5-6-4.
Для всех трех циклов можно записать
, Q¢ 3 /Q¢ 2 = Ф (Т 3 ,Т 2 ), .
Следует заметить, что в круговом процессе 1-2-3-4-1 теплота Q¢ 2 , отводимая холодильником первой тепловой машины, равна теплоте, подводимой к рабочему телу второй машины, которой соответствует круговой процесс 4-3-5-6-4, т.е. холодильник первой машины выступает в качестве нагревателя второй. А суммарная работа двух тепловых машин равна работе объединённой тепловой машины, которой соответствует круговой процесс 1-2-5-6-1.
Так как Q¢ 3 /Q 1 = (Q¢ 3 /Q¢ 2) × (Q¢ 2 /Q 1) , то при этом должно выполняться равенство
Но левая часть не зависит от Т 2 . Это возможно в случае, когда , и .
Величина представляет собой термодинамическую температуру и при сопоставлении её с идеально-газовой шкалой может быть записана в виде = Т, где Т – температура, заданная шкалой Кельвина. Следовательно, шкала температур, построенная с использованием идеально-газового термометра, и термодинамическая шкала температур совпадают.
Таким образом, цикл Карно позволяет построить термодинамическую шкалу температур и предложить термодинамический термометр . Принцип действия такого термометра заключается в организации цикла Карно между телом с неизвестной температурой Т X и телом с известной температурой Т (например, с тающим льдом или кипящей водой) и измерении соответствующего количества теплоты Q X и Q. Применение формулы
Температур, не зависящая от свойств термометрического вещества (начало отсчета - абсолютный нуль температуры). Построение термодинамической температурной шкалы основано на втором начале термодинамики и, в частности, на независимости кпд Карно цикла от природы рабочего тела. Единица термодинамической температуры - кельвин (К) - определяется как 1/273,16 часть термодинамической температуры тройной точки воды.
Большой Энциклопедический словарь . 2000 .
Смотреть что такое "" в других словарях:
См. в ст. Температурная шкала. Физическая энциклопедия. В 5 ти томах. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988 … Физическая энциклопедия
- (см. ТЕМПЕРАТУРНЫЕ ШКАЛЫ). Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983 … Физическая энциклопедия
- (Кельвина шкала), абсолютная шкала температур, не зависящая от свойств термометрического вещества (начало отсчёта абсолютный нуль температуры). Построение термодинамической температурной шкалы основано на втором начале термодинамики и, в… … Энциклопедический словарь
термодинамическая температурная шкала - termodinaminė temperatūros skalė statusas T sritis Standartizacija ir metrologija apibrėžtis Temperatūros skalė, pagrįsta absoliučiuoju nuliu, t. y. žemiausia temperatūra, kurią teoriškai galima būtų pasiekti ir kuri yra 273,16 °C žemiau ledo… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
термодинамическая температурная шкала - termodinaminė temperatūros skalė statusas T sritis Energetika apibrėžtis Nepriklauso nuo termometrinės medžiagos ir turi vieną atskaitos tašką – vandens trigubąjį tašką, kuriam suteikta T = 273,16 K vertė. Termodinaminė temperatūros skalė… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
- (Кельвина шкала), абс. шкала темп р, не зависящая от свойств термометрич. в ва (начало отсчёта абс. нуль темп ры). Построение Т. т. ш. основано на втором начале термодинамики и, в частности, на независимости кпд Карно цикла от природы рабочего… … Естествознание. Энциклопедический словарь
См. Температурные шкалы … Большая советская энциклопедия
температурная шкала Кельвина - Термодинамическая шкала температуры (ТК), в которой 0°K=–273.16°C (1K=1°C). Syn.: абсолютная температурная шкала; шкала Келвина … Словарь по географии
ТЕМПЕРАТУРНАЯ ШКАЛА - ряд числовых точек на шкале термометра, распределённых внутри температурного интервала, ограниченного двумя точками постоянной температуры, принимаемыми за основные главные опорные точки (обычно для одинаковых физ. состояний, напр. температуры… … Большая политехническая энциклопедия
Хаотическое тепловое движение на плоскости частиц газа таких как атомы и молекулы Существует два определения температуры. Одно с молекулярно кинетической точки зрения, другое с термодинамической. Температура (от лат. temperatura надлежащее… … Википедия
Молекулярно-кинетическое определение
Измерение температуры
Для измерения температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры.
На практике для измерения температуры используют
Единицы и шкала измерения температуры
Из того, что температура - это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах - градусах.
Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры - кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры - абсолютный ноль , то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что приблизительно равно −273.15 °C.
Шкала температур Кельвина - температурная шкала, в которой начало отсчёта ведётся от абсолютного нуля .
Используемые в быту температурные шкалы - как Цельсия , так и Фаренгейта (используемая, в основном, в США), - не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина , а другая - абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что кельвин равен градусу Цельсия, а градус Ранкина - градусу Фаренгейта.
Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K. Число градусов Цельсия и кельвинов между точками замерзания и кипения воды одинаково и равно 100. Поэтому градусы Цельсия переводятся в кельвины по формуле K = °C + 273,15.
Шкала Цельсия
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия - это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F - 32), 1 °F = 9/5 °С + 32. Предложена Г. Фаренгейтом в 1724.
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному. Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остается в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решётки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 1x10 6 м/с.
Температура, при которой частицы вещества имеют минимальное количество движения, сохраняющееся только благодаря квантовомеханическому движению, - это температура абсолютного нуля (Т = 0К).
Температуры абсолютного нуля достичь невозможно. Наиболее низкая температура (450±80)x10 -12 К конденсата Бозе-Эйнштейна атомов натрия была получена в 2003 г. исследователями из МТИ . При этом пик теплового излучения находится в области длин волн порядка 6400 км, то есть примерно радиуса Земли.
Температура с термодинамической точки зрения
Существует множество различных шкал температур. Когда-то температура определялась очень произвольно. Мерой температуры служили метки, нанесённые на равных расстояниях на стенах трубочки, в которой при нагревании расширялась вода. Потом решили измерить температуру и обнаружили, что градусные расстояния не одинаковы. В термодинамике дается определение температуры, не зависящее от каких-либо частных свойств вещества.
Введем функцию f (T ) , которая не зависит от свойств вещества. Из термодинамики следует, что если какая-то тепловая машина, поглощая количество теплоты Q 1 при T 1 выделяет тепло Q s при температуре в один градус , а другая машина, поглотив тепло Q 2 при T 2 , выделяет то же самое тепло Q s при температуре в один градус, то машина, поглощающая Q 1 при T 1 должна при температуре T 2 выделять тепло Q 2 .
Конечно, между теплом Q и температурой T существует зависимость и тепло Q 1 должно быть пропорционально Q s . Таким образом, каждому количеству тепла Q s , выделенного при температуре в один градус, соответствует количество тепла, поглощённого машиной при температуре T , равное Q s , умноженному на некоторую возрастающую функцию f температуры:
Q = Q s f (T )Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
Для системы, в которой энтропия S может быть функцией S (E ) её энергии E , термодинамическая температура определяется как:
Температура и излучение
При повышении температуры растёт энергия, излучаемая нагретым телом. Энергия излучения абсолютно чёрного тела описывается законом Стефана - Больцмана
Шкала Реомюра
Предложена в году Р. А. Реомюром , который описал изобретённый им спиртовой термометр.
Единица - градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками - температурой таяния льда (0 °R) и кипения воды (80 °R)
1 °R = 1,25° C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции , на родине автора.
Переходы из разных шкал
Сравнение температурных шкал
| Описание | Кельвин | Цельсий | Фаренгейт | Ранкин | Делиль | Ньютон | Реомюр | Рёмер |
|---|---|---|---|---|---|---|---|---|
| Абсолютный ноль | 0 | −273.15 | −459.67 | 0 | 559.725 | −90.14 | −218.52 | −135.90 |
| Температура таяния смеси Фаренгейта (соль и лёд в равных количествах) | 255.37 | −17.78 | 0 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 |
| Температура замерзания воды (Нормальные условия) | 273.15 | 0 | 32 | 491.67 | 150 | 0 | 0 | 7.5 |
| Средняя температура человеческого тела ¹ | 310.0 | 36.6 | 98.2 | 557.9 | 94.5 | 12.21 | 29.6 | 26.925 |
| Температура кипения воды (Нормальные условия) | 373.15 | 100 | 212 | 671.67 | 0 | 33 | 80 | 60 |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Поверхность Солнца | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹ Нормальная средняя температура человеческого тела - 36.6 ° C ±0.7 ° C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F - это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 ° C. Однако это значение не входит в диапазон нормальной средней температуры тела человека, поскольку температура разных частей тела разная
Термодинами́ческая Температу́рная шкала́ (Кельвина шкала), абсолютная шкала температур, не зависящая от свойств термометрического вещества (начало отсчета - абсолютный нуль температуры). Построение термодинамической температурной шкалы основано на втором начале термодинамики и, в частности, на независимости кпд Карно цикла от природы рабочего тела. Единица термодинамической температуры - кельвин (К)
Статистический вес и энтропия.
Энтропия - в естественных науках мера неупорядоченности системы, состоящей из многих элементов. В частности, в статистической физике - мера вероятности осуществления какого-либо макроскопического состояния.
Где - приращение энтропии; - минимальная теплота, подведённая системе; - абсолютная температура процесса.
Статистический вес в термодинамике и статистической физике - число способов, которыми может быть реализовано данное макроскопическое состояние системы. Статистический вес связан с энтропией S системы соотношением Больцмана ,
Где k = R/N = 1,38*10 -23 Дж/К
где k - фундаментальная мировая постоянная Больцмана;
R = 8,31 Дж/(моль*К) - молярная газовая постоянная;
N = 6,06*10 23 моль -1 - число Авогадро;
Р - статистический вес: число способов осуществления данного состояния.
Параметр S - энтропия - служит мерой рассеяния энергии Вселенной, а Р - характеризует любые самопроизвольные изменения, эта величина относится к миру атомов, определяющих скрытый механизм изменения.
Билет
Равновесное состояние. Диаграммы состояний. Уравнение состояния. Уравнение состояния разреженных газов. Идеальный газ. Уравнение состояния не разреженных газов (уравнение Ван-дер-Ваальса)
Равновесное состояние - состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений. Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в метастабильном равновесии. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы (или движущие силы), изменения количества присутствующих фаз. Отличают тепловое, механическое, радиационное (лучистое) и химическое равновесия.
1)равновесие достигается в какой-либо части (или частях) относительно большой по размерам системы - локальное равновесие,
2)неполное равновесие достигается вследствие разности скоростей релаксационных процессов, протекающих в системе - частичное равновесие,
3)имеют место как локальное, так и частичное равновесие.
В неравновесных системах происходят изменения потоков материи или энергии, или, например, фаз.
Диаграммы состояний.
диаграмма равновесия, фазовая диаграмма, графическое изображение равновесных фазовых состояний одно- или многокомпонентных систем при разных значениях параметров, определяющих эти состояния. Диаграммы состояния изображают фазовый состав системы при разных концентрациях компонентов (Х), температурах (Т) и давлении (Р).
Диаграммы являются пространственными. Мерность пространства зависит от числа независимых переменных, функцией которых является фазовый состав. Диаграмма состояния может быть двумерной, трехмерной и многомерной. Переменные (Р, Т, Х) являются координатами, в которых строится диаграмма. Каждая точка диаграммы состояния (фигуративная точка) указывает на фазовый состав вещества при заданных значениях термодинамических параметров (координат этой точки). Когда система состоит только из одного компонента, диаграмма состояния представляет собой трехмерную пространственную фигуру, построенную в трех прямоугольных координатных осях, по которым откладывают температуру (Т), давление (Р) и мольный объем (v). На практике часто применяют проекцию диаграммы состояния на одну из координатных плоскостей, обычно на плоскость Р - Т.
Разреженные газы.
Разреженным в физике называют такое состояние газа, при котором средняя длина свободного пробега молекул превышает линейные размеры сосуда, содержащего газ. Это состояние называют также вакуумом. Поведение разреженных газов отличается целым рядом особенностей. Поскольку в вакууме молекулы газа пробегают расстояние от одной стенки до другой без столкновений, то не существует давления одной части газа на другую; можно говорить лишь о давлении газа на стенки сосуда. В разреженных газах не существует внутреннего трения и явления теплопроводности в обычном смысле. Физический вакуум при комнатных температурах реализуется в газах при давлении менее 10 -5 мм рт. ст., если газ находится в объеме с линейными размерами порядка метра.
В технике под вакуумом понимают состояние газа при давлении ниже атмосферного. Степень технического вакуума оценивается величиной давления остаточного газа.
Идеальный газ.
Идеальный газ - математическая модель газа, в которой предполагается, что:
1) потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией;
2) суммарный объём молекул газа пренебрежимо мал;
3) между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги;
4) время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
В расширенной модели идеального газа частицы, из которого он состоит, имеют форму упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц.
Уравнение состояния идеального газа(уравнение Клайперона)
![]()
Уравнение состояния не разреженных газов (уравнение Ван-дер-Ваальса
)  ,
,
Билет.
Механическая форма передачи энергии телу. Работа. Тепловая форма передачи энергии телу. Теплота. Первое начало термодинамики. Равновесно совершемая работа, равновесно подводимая теплота
Абсолютный нуль. Термодинамическая шкала
температур. Абсолютная температура.
Основное уравнение кинетической теории газов
Мы знаем, что давление газа пропорционально концентрации молекул р~n. Зависит от кинетической энергии:
ν- это средняя скорость молекул. Объединим полученные соотношенияр~n*(mν 2 /2). Переходя к равенству, необходимо ввести коэффициент пропорциональности с
Р=сn(mν 2 /2)
Применив строгий вывод, можно доказать, что с= 2/3
Основное уравнение молекулярно-кинетической теории: р=(2/3)n(mν 2 /2)
Р=(2/3)nЕ пос
Е пос - кинетическая энергия поступательного движения. Температура, при которой должно прекратиться поступательное движение молекул, называется абсолютным нулём.
Абсолютный нуль -t=-273,15 0 С. В международной системе единиц принято термодинамическая шкала температур. За начало отсчёта – абсолютный нуль. Это самое возможное из низких температур, поэтому на термодинамической шкале нет отрицательных температур. Эту шкалу называют шкалой Кельвина. В повседневной жизни мы используем шкалу Цельсия. За нулевую точку принята температура таяния льда. За вторую опорную точку термодинамической шкалы принята температура, при которой вода находится одновременно в трёх состояниях (твёрдом, жидком, газообразном). Это состояние получило название тройной точкой: по Цельсию это 0,01 0 С, а по термодинамической шкале 273,16 единиц (1единица называется кельвином). Такой выбор сделан, чтобы
Температуру, отсчитываемую по термодинамической шкале называют абсолютной температурой.
Т=(273,15+t)К t=(Т-273,15) 0 С
Уравнение кинетической энергии газов.
Связь температуры тела со скоростью движения его
частиц. р~n р~Т
Объединим обе эти экспериментально обнаруженные закономерности
р=knТ - Это соотношение является математическим выражением
результатов исследований. С другой стороны мы знаем: р=(2/3)×n×(m 0 ν 2)/2
knТ=(2/3)×n×(m 0 ν 2 /2),
Т=(1/k)×(2/3)×(m 0 ν 2 /2),
Т=(2/3)×(Е/k).
Температурой называют скалярную физическую величину, характеризующую интенсивность теплового движения молекул изолированной системы в условиях термодинамического равновесия, пропорционально средней кинетической энергии поступательного движения молекул.
Т=(1/k)(2/3)(m 0 ν 2 /2)
k в формуле называется постоянной Больцмана (в честь австрийского ученого М.Больцмана)
k=(2/3)(m 0 ×v 2)/T
Числитель – энергетическая температура в Джоулях;
Знаменатель – соответствующая температура в Кельвинах.
Следовательно: постоянная Больцмана равна отношению температуры в единицах энергии к той же температуре, выраженной в Кельвинах. k=1,380662×10 -23 Дж×К -1 .
ЧО 2 Уравнение Менделеева - Клапейрона
Частные случаи
В физике, как и в других науках, происходит со временем удивительный процесс. Многое из того, что сейчас можно уловить кратко и ясно, несколько десятилетий (веков) назад появились как новые истины, с большим трудом воспринимавшихся современниками. Со временем опыт человека заставляет принять новые идеи и привыкнуть к ним, а, привыкнув, человек начинает использовать их в практической деятельности как понятия и порой даже тривиальные. Примерно так же дело обстояло и с изучением газа. Древние учения считали газ неуловимой формой тела, представляющей собой нечто среднее между веществом и духом. Но такой взгляд существовал до тех пор, пока не потребовалось описание явления. Количественные характеристики и постановка эксперимента в XVII веке Торричелли и Паскаля показали, что воздух имеет вес. С этих пор физики начали изучать свойства газов. Новые взгляды потрясли физиков не меньше, чем открытия XX века.
Термодинамические параметры газа : Макроскопические параметры газа (давление, объем, температура и т.д.) называются термодинамическими параметрами газа. Если взять определенную массу m, то при постоянных P, V и T газ будет находиться в равновесном состоянии. Когда происходит изменение этих параметров, то в газе происходит тот или иной процесс, который называется термодинамическим. Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом. Газовый закон выражающий связь между всеми тремя параметрами газа, называется объединенным газовым законом.