8. Keemiliste reaktsioonide klassifikatsioon. OVR. Elektrolüüs
8.3. Redoksreaktsioonid: üldsätted
Redoxi reaktsioonid(ОВР) nimetatakse reaktsioone, mis toimuvad elementide aatomite oksüdatsiooniseisundi muutumisel. Nende reaktsioonide tulemusena annetavad mõned aatomid elektrone, teised aga võtavad need vastu.
Redutseeriv aine on aatom, ioon, molekul või PU, mis loobub elektronidest, oksüdeeriv aine on aatom, ioon, molekul või PU, mis võtab vastu elektronid:
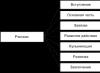
Elektronide annetamise protsessi nimetatakse oksüdatsiooniks ja elektronide vastuvõtmise protsessi ümberehitus... OVR -is peab olema redutseerija ja oksüdeeriv aine. Oksüdeerimisprotsessi ei toimu ilma redutseerimisprotsessita ega redutseerimisprotsessi ilma oksüdatsiooniprotsessita.
Redutseerija annetab elektrone ja oksüdeerub ning oksüdeeriv aine võtab vastu elektrone ja redutseerub
Redutseerimisprotsessiga kaasneb aatomite oksüdatsiooniastme vähenemine ja oksüdatsiooniprotsessiga kaasneb elementide aatomite oksüdatsiooniastme tõus. Ülaltoodut on mugav illustreerida skeemiga (CO - oksüdatsiooni olek):

Konkreetsed näited oksüdeerimis- ja redutseerimisprotsessidest (elektroonilised tasakaaluskeemid) on toodud tabelis. 8.1.
Tabel 8.1
Elektroonilise tasakaalu skeemide näited
| Elektrooniline tasakaaluahel | Protsessi iseloomustus |
|---|---|
| Oksüdeerimisprotsess | |
| Kaltsiumiaatom annetab elektrone, suurendab oksüdatsiooni, on redutseerija | |
| Cr +2 ioon annetab elektrone, suurendab oksüdatsiooni, on redutseerija | |
| Kloorimolekul annetab elektrone, klooriaatomid suurendavad oksüdatsiooni olekut 0 -lt +1 -le, kloor on redutseeriv aine | |
| Taastumisprotsess | |
| Süsinikuaatom võtab vastu elektrone, alandab oksüdatsiooniseisundit, on oksüdeeriv aine | |
| Hapniku molekul võtab vastu elektrone, hapniku aatomid alandavad oksüdatsiooni olekut 0 kuni -2, hapniku molekul on oksüdeeriv aine | |
| Ioon võtab vastu elektrone, alandab oksüdatsiooniseisundit, on oksüdeeriv aine | |
Kõige olulisemad redutseerijad: lihtsad ained metallid; vesinik; süsinik koksina; vingugaas (II); madalaima oksüdatsiooniastmega aatomeid sisaldavad ühendid (metallhüdriidid, sulfiidid, jodiidid, ammoniaak); tugevaim redutseerija on katoodi elektrivool.
Kõige olulisemad oksüdeerijad: lihtsad ained - halogeenid, hapnik, osoon; kontsentreeritud väävelhape; Lämmastikhape; hulk sooli (KClO 3, KMnO 4, K 2 Cr 2 O 7); vesinikperoksiid H202; kõige võimsam oksüdeeriv aine on anoodil olev elektrivool.
Aja jooksul suurenevad aatomite ja lihtsate ainete oksüdeerivad omadused: fluor - kõigi lihtsate ainete tugevaim oksüdeerija... Igal perioodil moodustavad halogeenid lihtsaid aineid, millel on kõige tugevamad oksüdeerivad omadused.
Rühmades A ülalt alla aatomite ja lihtsate ainete oksüdeerivad omadused nõrgenevad ning redutseerivad omadused paranevad.
Sama tüüpi aatomite puhul suurenevad redutseerivad omadused nende raadiuse suurenemisega; näiteks aniooni redutseerivad omadused
I - on rohkem väljendunud kui Cl - anioon.
Metallide puhul määratakse lihtsate ainete ja ioonide redoksomadused vesilahuses metalli positsiooni järgi elektrokeemilises seerias: vasakult paremale (ülevalt alla) nõrgenevad lihtmetallide redutseerivad omadused: tugevaim reduktor- liitium.
Metalliioonide vesilahuses vasakult paremale samas reas on oksüdeerivad omadused paranenud: kõige võimsam oksüdeeriv aine- ioonid Au 3 +.
Koefitsientide korrastamiseks ORR -is saate kasutada meetodit, mis põhineb oksüdatsiooni- ja redutseerimisprotsesside diagrammide koostamisel. Seda meetodit nimetatakse elektrooniline tasakaalu meetod.
Elektroonilise tasakaalu meetodi olemus on järgmine.
1. Koostage reaktsiooniskeem ja tuvastage oksüdatsiooni olekut muutnud elemendid.
2. Tehke elektroonilised võrrandid redutseerimise ja oksüdatsiooni poolreaktsioonidest.
3. Kuna redutseerija poolt annetatud elektronide arv peab olema võrdne oksüdeeriva aine annetatud elektronide arvuga, leitakse lisategurid vähim levinud mitmekordse (LCM) meetodi abil.
4. Vastavate ainete valemite ette pannakse täiendavad tegurid (koefitsient 1 jäetakse välja).
5. Võrdsustada nende elementide aatomite arvu, mis ei ole oksüdatsiooni olekut muutnud (esiteks - vesinik vee kohal ja seejärel - hapniku aatomite arv).
Näide redoksreaktsiooni võrrandi koostamisest
elektroonilise tasakaalu meetodil.
Leiame, et süsiniku- ja väävliaatomid on muutnud oksüdatsiooni olekut. Koostame redutseerimise ja oksüdatsiooni poolreaktsioonide võrrandid:
Sel juhul on LCM 4 ja täiendavad tegurid on 1 (süsiniku puhul) ja 2 (väävelhappe puhul).
Panime leitud täiendavad tegurid reaktsiooniskeemi vasakusse ja paremasse ossa süsinikku ja väävlit sisaldavate ainete valemite ette:
C + 2H 2 SO 4 → CO 2 + 2SO 2 + H 2 O
Me võrdsustame vesiniku aatomite arvu, pannes veevalemi ette koefitsiendi 2 ja veendume, et hapniku aatomite arv mõlemal pool võrrandit on sama. Seetõttu OVR võrrand
C + 2H 2SO 4 = CO 2 + 2SO 2 + 2H 2O
Tekib küsimus: millisesse OVR skeemi ossa tuleks paigutada leitud lisategurid - vasakule või paremale?
Lihtsate reaktsioonide puhul pole see oluline. Siiski tuleb meeles pidada: kui võrrandi vasakpoolsel küljel määratakse täiendavad tegurid, siis koefitsiendid pannakse vasakpoolsete ainete valemite ette; kui arvutused viidi läbi parema külje jaoks, siis koefitsiendid pannakse võrrandi paremale küljele. Näiteks:
Al -aatomite arvu järgi vasakul:
Al -aatomite arvu järgi paremal küljel:
Üldjuhul, kui reaktsioonis osalevad molekulaarstruktuuriga ained (O 2, Cl 2, Br 2, I 2, N 2), siis valitakse koefitsiendid molekuli aatomite arvu järgi:
Kui reaktsioonis moodustub HNO 3 N 2 O, siis on ka lämmastiku elektroonilise tasakaalu skeem paremini kirjutatud kahe lämmastikuaatomi põhjal .
Mõnes redoksreaktsioonis võib üks ainetest toimida nii oksüdeeriva (redutseeriva) kui ka soola moodustava ainena (st osaleda soola moodustamises).
Sellised reaktsioonid on iseloomulikud eelkõige metallide koostoimele oksüdeerivate hapetega (HNO 3, H 2 SO 4 (konts)), samuti oksüdeerivatele sooladele (KMnO 4, K 2 Cr 2 O 7, KClO 3, Ca ( OCl) 2) vesinikkloriidhappega (Cl -anioonide tõttu - vesinikkloriidhappel on redutseerivad omadused) ja teiste hapetega, mille anioon on redutseerija.
Koostame võrrandi vase reaktsiooniks lahjendatud lämmastikhappega:
Näeme, et osa lämmastikhappe molekulidest kulutatakse vase oksüdeerimiseks, samal ajal redutseerides lämmastikoksiidiks (II), ja osa läheb moodustunud Cu 2+ ioonide sidumiseks Cu (NO 3) 2 soolaga soola koostis, lämmastikuaatomi oksüdatsiooniaste on sama mis happes, st ei muutu). Sellistes reaktsioonides asetatakse oksüdeeriva elemendi jaoks täiendav tegur alati paremale küljele enne redutseerimisprodukti valemit, antud juhul enne valemit NO, mitte HNO 3 või Cu (NO 3) 2.
Valemi HNO 3 ette paneme koefitsiendi 8 (kaks HNO 3 molekuli kulutatakse vase oksüdeerimiseks ja kuus - kolme Cu 2+ iooni soolaks sidumiseks), võrdsustame H ja O arvud aatomid ja saada
3Cu + 8HNO3 = 3Cu (NO 3) 2 + 2NO + 4H 2O.
Muudel juhtudel võib hape, näiteks vesinikkloriidhape, olla samaaegselt nii redutseerija kui ka osaleda soola moodustamises:
Näide 8.5. Arvutage, kui palju HNO 3 kulub soola moodustamiseks reaktsiooni ajal, mille võrrand
tsink siseneb massiga 1,4 g.
Lahendus. Reaktsioonivõrrandist näeme, et 8 moolist lämmastikhappest läks ainult 2 mooli 3 mooli tsingi oksüdeerumiseks (enne happe redutseerimisprodukti valemit EI on tegur 2). Soolamine tarbis 6 mooli hapet, mida on lihtne määrata, korrutades Zn (HNO 3) 2 soolavalemi ees oleva teguri 3 ühe happejääkide arvuga ühes valemiga soolaühikus, s.t. 2.
n (Zn) = 1,4 / 65 = 0,0215 (mol).
x = 0,043 mol;
m (HNO 3) = n (HNO 3) M (HNO 3) = 0,043 × 63 = 2,71 (g)
Vastus: 2,71 g.
Mõnes OVR -is muudavad oksüdatsiooni olekut mitte kahe, vaid kolme elemendi aatomid.
Näide 8.6. Asetage koefitsiendid ORR -i, mis voolab vastavalt skeemile FeS + O 2 → Fe 2 O 3 + SO 2, kasutades elektroonilist tasakaalu meetodit.
Lahendus. Näeme, et oksüdatsiooni olekut muudavad kolme elemendi aatomid: Fe, S ja O. Sellistel juhtudel võetakse kokku erinevate elementide aatomite poolt annetatud elektronide arv:
Pärast stöhhiomeetriliste koefitsientide paigutamist saame:
4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2.
Vaatleme näiteid muud tüüpi eksamiülesannete lahendamiseks sellel teemal.
Näide 8.7. Märkida elektronide arv, mis on redutseerijalt oksüdeerijale üle kantud pärast vask (II) nitraadi täielikku lagunemist, kaaluga 28,2 g.
Lahendus. Kirjutame üles soola lagunemisreaktsiooni võrrandi ja OVR elektroonilise tasakaalu skeemi; M = 188 g / mol.
Näeme, et 4 mooli soola lagunemisel tekib 2 mol O 2. Sel juhul kantakse redutseeriva aatomilt (antud juhul on need ioonid) 4 mol elektroni oksüdeerivale ainele (st ioonidele): ... Kuna keemiline soola kogus on n = 28,2 / 188 = = 0,15 (mol), on meil:
2 mol soola - 4 mol elektroni
0,15 mol - x
n (e) = x = 4 ⋅ 0,15 / 2 = 0,3 (mol),
N (e) = N A n (e) = 6,02 ⋅ 10 23 ⋅ 0,3 = 1,806 ⋅ 10 23 (elektronid).
Vastus: 1.806 ⋅ 10 23.
Näide 8.8. Kui väävelhape interakteerub magneesiumi keemilise kogusega 0,02 mol, lisasid väävliaatomid 7,244 × 10 22 elektroni. Leidke happe vähendamise toote valem.
Lahendus. Üldjuhul võivad väävelhappe koostises sisalduvate väävliaatomite redutseerimise protsesside skeemid olla järgmised:
neid. 1 mool väävliaatomit võib võtta 2, 6 või 8 mooli elektroni. Arvestades, et 1 mol hapet sisaldab 1 mol väävliaatomit, s.t. n (H 2 SO 4) = n (S), meil on:
n (e) = N (e) / NA = (7,224-1022) / (6,02-1023) = 0,12 (mol).
Arvutame 1 mooli happe poolt võetud elektronide arvu:
0,02 mol hapet võtab 0,12 mol elektroni
1 mol - x
n (e) = x = 0,12 / 0,02 = 6 (mol).
See tulemus vastab väävelhappe väävliks redutseerimise protsessile:
Vastus: väävel.
Näide 8.9. Süsiniku reageerimisel kontsentreeritud lämmastikhappega moodustub vesi ja kaks soola moodustavat oksiidi. Leidke reageerinud süsiniku mass, kui oksüdeerivad aatomid võtsid selles protsessis 0,2 mol elektroni.
Lahendus. Ainete interaktsioon toimub vastavalt reaktsiooniskeemile
Koostame oksüdatsiooni ja redutseerimise poolreaktsioonide võrrandid:
Elektroonilistest tasakaaluskeemidest näeme, et kui oksüdeeriva aatomi () aatomid võtavad vastu 4 mol elektroni, siseneb reaktsiooni 1 mol (12 g) süsinikku. Koostame ja lahendame proportsiooni:
4 mooli elektroni - 12 g süsinikku
0,2 - x
x = 0,2 × 12 4 = 0,6 (d).
Vastus: 0,6 g.
Redoksreaktsioonide klassifikatsioon
Eristage molekulidevahelisi ja intramolekulaarseid redoksreaktsioone.
Millal molekulidevaheline OVR oksüdeerija ja redutseerija aatomid on osa erinevatest ainetest ja on erinevate keemiliste elementide aatomid.
Millal intramolekulaarne OVR oksüdeerija ja redutseerija aatomid on osa samast ainest. Intramolekulaarsete reaktsioonide hulka kuuluvad ebaproportsionaalsus, milles oksüdeerija ja redutseerija on sama aine keemilise elemendi aatomid. Sellised reaktsioonid on võimalikud ainete puhul, mis sisaldavad vahepealse oksüdatsiooniastmega aatomeid.
Näide 8.10. Märkige ebaproportsionaalsuse ümberjaotamise skeem:
1) MnO 2 + HCl → MnCl 2 + Cl 2 + H 2 O
2) Zn + H 2 SO 4 → ZnSO 4 + H 2
3) KI + Cl 2 → KCl + I 2
4) Cl 2 + KOH → KCl + KClO + H 2 O
Lahendus. Reaktsioonid 1) –3) on molekulidevaheline OVR:
Disproportsioonireaktsioon on reaktsioon 4), kuna see sisaldab klooriaatomit ning oksüdeerivat ja redutseerivat ainet:
Vastus: 4).
Aine redoksomadusi on võimalik kvalitatiivselt hinnata ainete koostises olevate aatomite oksüdatsiooniastmete analüüsi põhjal:
1) kui redoksomaduste eest vastutav aatom on kõrgeimas oksüdatsiooniastmes, siis ei saa see aatom enam elektrone annetada, vaid saab neid ainult vastu võtta. Seetõttu eksponeeritakse seda ainet OVR -is ainult oksüdeerivad omadused... Selliste ainete näited (valemid näitavad redoksomaduste eest vastutava aatomi oksüdatsiooniastet):
2) kui redoksomaduste eest vastutav aatom on madalaimas oksüdatsiooniastmes, ilmneb see aine ORP -s ainult taastavad omadused(see aatom ei suuda enam elektrone vastu võtta, ta saab neid ainult ära anda). Selliste ainete näited:,. Seetõttu on kõigil halogeenanioonidel ainult redutseerivad omadused ORR -is (välja arvatud F -, mille oksüdeerimiseks kasutatakse anoodil elektrivoolu), sulfiidioon S 2–, lämmastikuaatom ammoniaagi molekulis ja hüdriidioon H -. Metallidel (Na, K, Fe) on ainult redutseerivad omadused;
3) kui elemendi aatom on vahepealses oksüdatsiooniastmes (oksüdatsiooniaste on suurem kui miinimum, kuid väiksem kui maksimum), siis ilmneb vastav aine (ioon) sõltuvalt tingimustest kahekordne oksüdatiivselt-taastavad omadused: tugevamad oksüdeerijad oksüdeerivad neid aineid (ioone) ja tugevamad redutseerijad vähendavad neid. Selliste ainete näited: väävel, kuna väävliaatomi kõrgeim oksüdatsiooniaste on +6 ja madalaim on –2, vääveloksiid (IV), lämmastikoksiid (III) (lämmastikuaatomi kõrgeim oksüdatsiooniaste on +5 ja madalaim on –3), vesinikperoksiid (hapnikuaatomi kõrgeim oksüdatsiooniaste on +2 ja madalaim –2). Kahekordsed redoksomadused ilmnevad metalliioonides oksüdatsiooni vahepealses olekus: Fe 2+, Mn +4, Cr +3 jne.
Näide 8.11. Redoksreaktsiooni ei saa jätkata, mille skeem:
1) Cl 2 + KOH → KCl + KClO 3 + H 2 O
2) S + NaOH → Na2S + Na2S03 + H20
3) KClO → KClO 3 + KClO 4
4) KBr + Cl 2 → KCl + Br
Lahendus. Reaktsioon, mille skeem on näidatud numbril 3), ei saa toimuda, kuna selles on redutseerija, kuid oksüdeerivat ainet pole:
Vastus: 3).
Mõne aine puhul on redoksduaalsus tingitud sellest, et nende koostises on erinevaid aatomeid nii madalaimas kui ka kõrgeimas oksüdatsiooniastmes; näiteks vesinikkloriidhape (HCl) on vesinikuaatomi tõttu oksüdeeriv aine (kõrgeim oksüdatsiooniaste, võrdne +1) ja redutseerija Cl -aniooni tõttu (madalaim oksüdatsiooniaste).
OVR on võimatu ainete vahel, millel on ainult oksüdeeriv toime (HNO 3 ja H 2 SO 4, KMnO 4 ja K 2 CrO 7) või ainult redutseerivad omadused (HCl ja HBr, HI ja H 2 S)
OVR on oma olemuselt äärmiselt levinud (ainevahetus elusorganismides, fotosüntees, hingamine, lagunemine, põletamine), neid kasutatakse laialdaselt erinevatel eesmärkidel (metallide hankimine maakidest, hapetest, leelistest, ammoniaagist ja halogeenidest, keemiliste vooluallikate loomine, saamine soojus ja energia erinevate ainete põletamisel). Pange tähele, et OVR raskendab sageli meie elu (toidu, puu- ja köögiviljade riknemine, metallide korrosioon - kõik see on seotud erinevate redoksprotsesside käiguga).
Oksüdeerijad Kas osakesed (aatomid, molekulid või ioonid) on sellised elektronid vastu võtta keemilise reaktsiooni ajal. Sel juhul oksüdeeriva aine oksüdatsiooniaste läheb alla... Antud juhul oksüdeerijad taastuma.
Redutseerivad ained Kas osakesed (aatomid, molekulid või ioonid) on sellised annetada elektrone keemilise reaktsiooni ajal. Sel juhul redutseerija oksüdeerumisaste tõuseb... Samal ajal redutseerivad ained oksüdeerunud.
Kemikaale saab liigitada järgmistesse kategooriatesse tüüpilised oksüdeerijad, tüüpilised redutseerijad ja ained, mida saab eksponeerida nii oksüdeerivad kui ka redutseerivad omadused... Mõned ained praktiliselt ei näita redoksaktiivsust.
TO tüüpilised oksüdeerijad sisaldab:
- lihtsad mittemetallist ained tugevaimate oksüdeerivate omadustega (fluor F 2, hapnik O 2, kloor Cl 2);
- ioonidmetallid või mittemetallid koos kõrge positiivne (tavaliselt kõrgem) oksüdatsiooniaste : happed (HN +5 O 3, HCl +7 O 4), soolad (KN +5 O 3, KMn +7 O 4), oksiidid (S +6 O 3, Cr +6 O 3)
- ühendid, mis sisaldavad mõnda metallist katioonid omades kõrge oksüdatsiooniaste: Pb 4+, Fe 3+, Au 3+ jne.
Tüüpilised redutseerijad Reeglina on:
- lihtsad ained-metallid(metallide redutseerimisvõime määratakse kindlaks mitmete elektrokeemiliste aktiivsuste järgi);
- keerulised ained, mis sisaldavad negatiivse (tavaliselt madalaima) oksüdatsiooniastmega mittemetallide aatomid või ioonid: binaarsed vesinikühendid (H 2 S, HBr), anokshapete soolad (K 2 S, NaI);
- mõned ühendid sisaldavad minimaalse positiivse oksüdatsiooniastmega katioonid(Sn 2+, Fe 2+, Cr 2+), mis annetavad elektrone, võib suurendada nende oksüdatsiooni;
- ühendid, mis sisaldavad kompleksseid ioone, mis koosnevad mittemetallid, millel on vahepealne positiivne oksüdatsiooniaste(S +4 O 3) 2–, (НР +3 O 3) 2–, milles elemendid võivad annetada elektrone, suurendada oma positiivset oksüdatsiooni.
Enamik teisi aineid võib eksponeerida nii oksüdeerivad kui ka redutseerivad omadused.

Tüüpilised oksüdeerivad ja redutseerivad ained on loetletud tabelis.

Laboratoorses praktikas kõige sagedamini kasutatavad on järgmised oksüdeerijad :
kaaliumpermanganaat (KMnO 4);
kaaliumdikromaat (K 2 Cr 2 O 7);
lämmastikhape (HNO 3);
kontsentreeritud väävelhape (H 2 SO 4);
vesinikperoksiid (H202);
mangaan (IV) ja plii (IV) oksiidid (MnO 2, PbO 2);
sula kaaliumnitraat (KNO 3) ja mõnede teiste nitraatide sulamine.
TO restauraatorid mis kehtivad v laboripraktika seostama:
- magneesium (Mg), alumiinium (Al), tsink (Zn) ja muud aktiivsed metallid;
- vesinik (H2) ja süsinik (C);
- kaaliumjodiid (KI);
- naatriumsulfiid (Na 2 S) ja vesiniksulfiid (H 2 S);
- naatriumsulfit (Na2S03);
- tina kloriid (SnCl 2).
Redoksreaktsioonide klassifikatsioon
Redoxi reaktsioonid jagunevad tavaliselt nelja tüüpi: molekulidevahelised, intramolekulaarsed, disproportsioonireaktsioonid (eneseoksüdatsioon-isetervendumine) ja ebaproportsionaalsed reaktsioonid.
Intermolekulaarsed reaktsioonid jätkake oksüdatsiooni oleku muutmist erinevaid elemente alates erinevad reaktiivid... Sel juhul, mitmesugused oksüdeerimis- ja redutseerimissaadused .
2Al 0 + Fe +3 2 O 3 → Al + 3 2 O 3 + 2 Fe 0,
C 0 + 4HN + 5 O 3 (konts) = C + 4 O 2 + 4 N + 4 02 + 2 H 2 O.
Intramolekulaarsed reaktsioonid Kas sellised reaktsioonid, milles erinevaid elemente alates üks reagent minema näiteks erinevaid tooteid:
(N -3H4) 2 Cr +6 2 O 7 → N 2 0 + Cr + 3 2 O 3 + 4 H 2 O,
2 NaN +5 O -2 3 → 2 NaN +3 O 2 +O 0 2.
Disproportsioonireaktsioonid (iseoksüdatsioon-isetervendumine) on reaktsioonid, mille käigus oksüdeeriv aine ja redutseerija- ühe reaktiivi sama element, millesse samal ajal läheb erinevaid tooteid:
3Br 2 + 6 KOH → 5KBr + KBrO 3 + 3 H 2O,
Proportsionaalsus (proportsioonid, ebaproportsionaalsus ) On reaktsioonid, milles esinevad oksüdeeriv ja redutseeriv aine sama ese, Milline neist erinevad reaktiivid läheb sisse üks toode... Ebaproportsionaalsusele vastupidine reaktsioon.
2H 2S -2 + S +402 = 3S + 2H 2O

Redoksreaktsioonide koostamise põhireeglid
Redoxi reaktsioonidega kaasnevad oksüdatsiooni- ja redutseerimisprotsessid:
Oksüdeerimine Kas reduktori poolt elektronide annetamise protsess.
Taastumine Kas elektronide kinnitamise protsess oksüdeeriva aine abil.
Oksüdeeriv aine taastubja redutseerija oksüdeerub .
Redoksreaktsioonides, elektrooniline tasakaal: elektronide arv, millest redutseerija loobub, on võrdne oksüdeeriva aine elektronide arvuga. Kui saldo on valesti koostatud, ei saa te keerukaid OVR -e koostada.
Redoksreaktsioonide (ORR) koostamiseks kasutatakse mitmeid meetodeid: elektroonilise tasakaalu meetod, elektron-ioonide tasakaalu meetod (poolreaktsiooni meetod) jt.
Mõelgem üksikasjalikult elektrooniline tasakaalu meetod .
OVR -i "tuvastamine" on üsna lihtne - piisab, kui korraldada kõikides ühendites oksüdatsioonitingimused ja teha kindlaks, et aatomid muudavad oksüdatsiooniastet:
K + 2 S -2 + 2K + Mn +7 O -2 4 = 2K + 2 Mn +6 O -2 4 + S 0
Kirjutame eraldi välja oksüdeerimisolekut muutvate elementide aatomid, olekus ENNE reaktsiooni ja PÄRAST reaktsiooni.
Oksüdatsiooni olekut muudavad mangaani ja väävli aatomid:
S -2 -2e = S 0
Mn +7 +1e = Mn +6
Mangaan neelab 1 elektroni, väävel annetab 2 elektroni. Sel juhul on vajalik, et elektrooniline tasakaal. Seetõttu on vaja kahekordistada mangaani aatomite arvu ja jätta väävliaatomite arv muutmata. Näitame tasakaalutegureid nii enne reaktiive kui ka enne tooteid!
OVR -i võrrandite koostamise skeem elektroonilise tasakaalu meetodil:

Tähelepanu! Reaktsioonis võib olla mitu oksüdeerivat või redutseerivat ainet. Tasakaal tuleb teha nii, et antud ja vastuvõetud elektronide KOKKU oleks sama.
Redoksreaktsioonide üldised mustrid
Redoxi reaktsioonisaadused sõltuvad sageli töötlemise tingimused... Kaaluge peamised redoksreaktsioonide kulgu mõjutavad tegurid.
Kõige ilmsem määraja on reaktsioonilahuse keskkond -. Tavaliselt (kuid mitte nõutav) on keskkonda määrav aine loetletud reagentide hulgas. Võimalikud on järgmised valikud.
- oksüdatiivne aktiivsus suureneb happelisemas keskkonnas ja oksüdeerija väheneb sügavamalt(näiteks kaaliumpermanganaat, KMnO 4, kus Mn +7 redutseeritakse happelises keskkonnas Mn +2 -ks ja leeliselises keskkonnas Mn +6 -ks);
- oksüdatiivne aktiivsus suureneb leeliselisemas keskkonnas, ja oksüdeeriv aine redutseeritakse sügavamale (näiteks kaaliumnitraat KNO 3, kus N +5 redutseerijaga interakteerumisel leeliselises keskkonnas redutseeritakse N -3 -ks);
- või keskkonnamuutused praktiliselt ei mõjuta oksüdeerivat ainet.

Reaktsioonikeskkond võimaldab määrata ülejäänud OVR toodete koostise ja olemasolu vormi. Põhiprintsiip on see, et moodustuvad tooted, mis ei reageeri reagentidega!
Märge! E Kui lahuse keskkond on happeline, ei saa reaktsioonisaaduste hulgas olla aluseid ja aluselisi oksiide, sest nad suhtlevad happega. Seevastu leeliselises keskkonnas on happe ja happelise oksiidi moodustumine välistatud. See on üks levinumaid ja rängemaid vigu.
Samuti mõjutab ORR -i voolu suunda reagentide olemus. Näiteks, lämmastikhappe HNO 3 ja redutseerivate ainete interaktsiooni ajal täheldatakse korrapärasust - mida suurem on redutseerija aktiivsus, seda rohkem väheneb lämmastik N +5.
Kui suureneb temperatuur enamik OVR -e jookseb reeglina intensiivsemalt ja sügavamalt.
Heterogeensetes reaktsioonides mõjutavad toodete koostist sageli tahkete ainete peenus ... Näiteks tsingipulbrist koos lämmastikhappega moodustuvad mõned tooted, samas kui granuleeritud tsingist moodustuvad täiesti erinevad tooted. Mida suurem on reaktiivi jahvatusaste, seda suurem on selle aktiivsus, tavaliselt.
Mõelgem kõige tüüpilisematele labori oksüdeerijatele.
Redoksreaktsioonide põhiskeemid
Permanganaadi taastamise skeem
Permanganaadid sisaldavad tugevat oksüdeerivat ainet - mangaan oksüdatsiooni olekus +7. Mangaani soolad +7 värvivad lahust lilla Värv.

Permanganaate redutseeritakse sõltuvalt reaktsioonilahuse keskkonnast erineval viisil.
V happeline keskkond taastumine toimub sügavamalt, enne Mn 2+... Mangaanoksiidil oksüdatsiooni olekus +2 on põhiomadused, seega happeline keskkond moodustub sool. Mangaani soolad +2 värvitu... V neutraalne lahus mangaan taastatakse oksüdatsiooni olekusse +4 , haridusega amfoteerne oksiid MnO 2 — pruun hapetes ja leelistes lahustumatu sete. V leeliseline keskkonda, vähendatakse mangaani minimaalselt - täpsusega oksüdatsiooni olek +6 ... Mangaaniühenditel +6 on happelised omadused, leeliselises keskkonnas moodustuvad soolad - manganaate... Manganaadid annavad lahusele roheline värvimine .

Vaatleme kaaliumpermanganaadi KMnO 4 koostoimet kaaliumsulfiidiga happelises, neutraalses ja aluselises keskkonnas. Nendes reaktsioonides on sulfiidioonide oksüdatsiooniprodukt S 0.
5 K 2 S + 2 KMnO 4 + 8 H 2 SO 4 = 5 S + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O,
3 K 2 S + 2 KMnO 4 + 4 H 2 O = 2 MnO 2 ↓ + 3 S ↓ + 8 KOH,
Selle reaktsiooni tavaline viga on väävli ja leelise koostoime märkimine reaktsioonisaadustes. Kuid väävel suhtleb leelisega üsna karmides tingimustes (kõrgendatud temperatuuril), mis ei vasta selle reaktsiooni tingimustele. Normaaltingimustes on õige märkida eraldi täpselt molekulaarne väävel ja leelis, mitte nende koostoime produktid.
K 2 S + 2 KMnO 4 - (KOH) = 2 K 2 MnO 4 + S ↓
Raskusi tekib ka selle reaktsiooni koostamisel. Fakt on see, et sel juhul ei ole reaktsiooni võrdsustamiseks vaja sisestada reagentidesse molekuli (KOH või muu leelis) molekul. Leelised osalevad reaktsioonis ja määravad kaaliumpermanganaadi redutseerimisprodukti, kuid reaktiivid ja saadused võrdsustatakse ilma selle osaluseta. Seda näiliselt paradoksi saab hõlpsasti lahendada, kui mäletame, et keemiline reaktsioon on vaid tingimuslik kirje, mis ei näita kõiki toimuvaid protsesse, vaid on vaid peegeldus kõigi protsesside summast. Kuidas seda ise kindlaks teha? Kui tegutsete vastavalt klassikalisele skeemile-tasakaalu-tasakaalu koefitsiendid-metalli võrdsustamine, siis näete, et metallid on tasakaalu koefitsientidega võrdsustatud ja leelise olemasolu reaktsioonivõrrandi vasakul küljel on üleliigne.
Permanganaadid oksüdeerida:
- mittemetallid negatiivse oksüdatsiooniastmega lihtsatele ainetele (oksüdatsiooniastmega 0), erandeid — fosfor, arseen - kuni +5 ;
- mittemetallid keskmise oksüdatsiooniastmega kõrgeima oksüdatsiooniastmeni;
- aktiivsed metallid stabiilselt positiivne metalli oksüdatsiooniaste.
KMnO 4 + neMe (madalam s.o.) = neMe 0 + muud tooted
KMnO 4 + neMe (vahepealne s.o.) = neMe (kõrgem s.o.) + muud tooted
KMnO 4 + Me 0 = Me (stabiilne s.o.) + muud tooted
KMnO 4 + P -3, As -3 = P +5, As +5 + muud tooted
Kromaadi / dikromaadi taaskasutamise skeem
Valentsusega VI kroomi eripära on see, et see moodustab vesilahustes 2 tüüpi sooli: kromaatid ja dikromaadid, sõltuvalt lahuse keskkonnast. Aktiivsete metallide kromaatid (näiteks K 2 CrO 4) on soolad, mis on stabiilsed leeliseline keskkonda. Aktiivsete metallide dikromaadid (dikromaadid) (näiteks K 2 Cr 2 O 7) - soolad, mis on stabiilsed happelises keskkonnas .
Kroom (VI) ühendid taandatakse kuni kroom (III) ühendid ... Kroomühendid Cr +3 on amfoteersed ja sõltuvalt lahuse keskkonnast eksisteerivad need lahuses erinevates vormides: happelises keskkonnas kujul soolad(amfoteersed ühendid moodustavad hapetega suheldes sooli), neutraalses keskkonnas - lahustumatu amfoteerne kroom (III) hüdroksiid Cr (OH) 3 ja leeliselises keskkonnas moodustuvad kroom (III) ühendid kompleksne sool, näiteks, kaaliumheksahüdroksokromaat (III) K 3 .

Kroom VI ühendid oksüdeerida:
- mittemetallid negatiivse oksüdatsiooni olekus lihtsatele ainetele (oksüdatsiooniastmega 0), erandeid — fosfor, arseen - kuni +5;
- mittemetallid vahepealses oksüdatsiooniasendis kõrgeima oksüdatsiooniastmeni;
- aktiivsed metallid alates lihtsatest ainetest (oksüdatsioonietapp 0) kuni ühenditeni stabiilselt positiivne metalli oksüdatsiooniaste.
Kromaat / dikromaat + neMe (negatiivne sr) = neMe 0 + muud tooted
Kromaat / dikromaat + neMe (vahepositiivne s.r.) = neMe (kõrgem sd) + muud tooted
Kromaat / dikromaat + Me 0 = Me (stabiilne s.o.) + muud tooted
Kromaat / dikromaat + P, As (negatiivne sr) = P, As +5 + muud tooted
Nitraatide lagunemine
Soolad-nitraadid sisaldavad lämmastik oksüdatsiooni olekus +5 - tugev oksüdeeriv aine... Selline lämmastik võib oksüdeerida hapnikku (O -2). See juhtub nitraatide kuumutamisel. Sellisel juhul oksüdeeritakse enamikul juhtudel hapnik oksüdeerumisse 0, st. enne molekulaarne hapnikku O 2 .
Sõltuvalt soola moodustava metalli tüübist moodustuvad nitraatide termilisel (temperatuuril) lagunemisel mitmesugused tooted: kui aktiivne metall(elektrokeemilise aktiivsuse seerias on magneesiumi juurde), seejärel lämmastik redutseeritakse oksüdeerumisse +3 ja lagunemisel moodustuvad soola-nitritid ja molekulaarne hapnik .
Näiteks:
2NaNO 3 → 2NaNO 2 + O 2.
Aktiivsed metallid esinevad looduslikult soolade kujul (KCl, NaCl).
Kui metall on elektrokeemilise aktiivsuse liinil magneesiumist paremal ja vasest vasakul (sh magneesium ja vask) , siis moodustub lagunemine metalloksiid stabiilses oksüdatsioonis, lämmastikoksiid (IV)(pruun gaas) ja hapnikku... Lagunemisel tekib ka metalloksiid liitiumnitraat .
Näiteks, lagunemine tsingi nitraat:
2Zn (NO 3) 2 → 2ZnО + 4NO 2 + O 2.
Keskmise aktiivsusega metalle leidub looduses kõige sagedamini oksiididena (Fe 2 O 3, Al 2 O 3 jne).
Joona metallid asub elektrokeemilise aktiivsuse reas vasest paremale on tugevad oksüdeerivad ained. Kell nitraatide lagunemine nad, nagu N +5, osalevad hapniku oksüdeerimisel ja taandatakse lihtsateks aineteks, s.t. moodustub metall ja gaasid vabanevad - lämmastikoksiid (IV) ja hapnik .
Näiteks, lagunemine hõbenitraat:
2AgNO 3 → 2Ag + 2NO 2 + O 2.
Mitteaktiivseid metalle leidub looduslikult lihtsate ainete kujul.
Mõned erandid!
Lagunemine ammooniumnitraat :
Ammooniumnitraadi molekul sisaldab nii oksüdeerivat kui ka redutseerivat ainet: -3 oksüdatsiooni olekus olev lämmastik avaldab ainult redutseerivaid omadusi, lämmastik oksüdeerimisastmes +5 ainult oksüdeerib.
Kuumutamisel ammooniumnitraat laguneb... Temperatuuril kuni 270 ° C, lämmastikoksiid (I)("Naerugaas") ja vesi:
NH 4 NO 3 → N 2 O + 2H 2 O
See on näide reaktsioonist ebaproportsionaalsus .
Saadud lämmastiku oksüdatsiooniaste on algmolekuli lämmastikuaatomite oksüdatsiooniastme aritmeetiline keskmine.
Kõrgemal temperatuuril laguneb lämmastikoksiid (I) lihtsateks aineteks - lämmastik ja hapnikku:
2NH 4 NO 3 → 2N 2 + O 2 + 4H 2O
Kell lagunemine ammooniumnitrit NH4NO2 esineb ka ebaproportsionaalsust.
Saadud lämmastiku oksüdatsiooniaste on samuti võrdne algsete lämmastikuaatomite oksüdeerimisolekute aritmeetilise keskmisega - oksüdeerija N +3 ja redutseerija N -3
NH4N02 → N2 + 2H20
Termiline lagunemine mangaan (II) nitraat millega kaasneb metalli oksüdeerumine:
Mn (NO 3) 2 = Mn02 + 2NO2
Raud (II) nitraat madalatel temperatuuridel laguneb see raud (II) oksiidiks, kuumutamisel oksüdeeritakse raud oksüdeerumisse +3:
2Fe (NO 3) 2 → 2FeO + 4NO 2 + O 2 60 ° C juures
4Fe (NO 3) 2 → 2Fe 2 O 3 + 8NO 2 + O 2> 60 ° C juures
Nikkel (II) nitraat
laguneb kuumutamisel nitritiks.
Lämmastikhappe oksüdeerivad omadused
Lämmastikhape HNO 3 metallidega praktiliselt suheldes ei moodusta kunagi vesinikku erinevalt enamikust mineraalhapetest.
See on tingitud asjaolust, et hape sisaldab väga tugevat oksüdeerivat ainet - lämmastikku oksüdeerumisolekus +5. Suheldes redutseerivate ainetega - metallidega, moodustuvad erinevad lämmastiku redutseerimisproduktid.
Lämmastikhape + metall = metallisool + lämmastikku vähendav toode + H 2 O
Lämmastikhape võib redutseerimisel siseneda lämmastikoksiid (IV) NO 2 (N +4); lämmastikoksiid (II) NO (N +2); lämmastikoksiid (I) N 2 O ("naerugaas"); molekulaarne lämmastik N2; ammooniumnitraat NH 4 NO 3... Reeglina moodustub toodete segu, kus üks neist on ülekaalus. Sel juhul vähendatakse lämmastikku oksüdeerimisseisunditesse +4 kuni −3. Taastumise sügavus sõltub eelkõige sellest oma olemuselt redutseerija ja lämmastikhappe kontsentratsiooni kohta ... Sel juhul töötab reegel: mida madalam on happe kontsentratsioon ja mida suurem on metalli aktiivsus, seda rohkem elektrone saab lämmastikku ja seda rohkem moodustuvad redutseeritud tooted.
Mõned seaduspärasused võimaldavad õigesti määrata põhitoodet lämmastikhappe redutseerimisel metallide poolt:
- tegevuses väga lahjendatud lämmastikhape peal metallid moodustub reeglina, ammooniumnitraat NH4NO3;
Näiteks, tsingi koostoime väga lahjendatud lämmastikhappega:
4Zn + 10HNO 3 = 4Zn (NO 3) 2 + NH 4 NO 3 + 3H 2O
- kontsentreeritud lämmastikhape külmas passiveerib mõned metallid - kroom Cr, alumiinium Al ja raud Fe ... Lahuse kuumutamisel või lahjendamisel reaktsioon jätkub;
metalli passiveerimine - see on metallpinna ülekandmine passiivsesse olekusse, kuna metallpinnale tekivad õhukesed inertsete ühendite kihid, antud juhul peamiselt metalloksiidid, mis ei reageeri kontsentreeritud lämmastikhappega
- Lämmastikhape ei reageeri plaatina alamrühma metallidega — kuld Au, plaatina Pt ja pallaadium Pd;
- suhtlemisel kontsentreeritud hape mitteaktiivsete metallidega ja keskmise aktiivsusega metallid lämmastik hape vähendatakse kuni lämmastikoksiid (IV) EI 2 ;
Näiteks, vase oksüdeerimine kontsentreeritud lämmastikhappega:
Cu + 4HNO3 = Cu (NO3) 2 + 2NO2 + 2H20
- suhtlemisel kontsentreeritud lämmastikhape aktiivsete metallidega moodustatud Lämmastikoksiid (I) N 2O ;
Näiteks, oksüdatsioon naatrium keskendunud lämmastikhape:
Na + 10HNO3 = 8NaNO3 + N20 + 5H20
- suhtlemisel lahjendage lämmastikhape mitteaktiivsete metallidega (tegevuste reas vesinikust paremal) redutseeritakse hape kuni lämmastikoksiid (II) NO ;
- suhtlemisel lahjendage lämmastikhape keskmise aktiivsusega metallidega moodustatud kas lämmastikoksiid (II) NO või lämmastikoksiid N 2O või molekulaarne lämmastik N 2 - sõltuvalt lisateguritest (metalli aktiivsus, metalli jahvatusaste, happe lahjendusaste, temperatuur).
- suhtlemisel lahjendage lämmastikhape aktiivsete metallidega moodustatud molekulaarne lämmastik N 2 .
Lämmastikhappe redutseerimise saaduste ligikaudseks määramiseks erinevate metallidega suhtlemisel teen ettepaneku kasutada pendli põhimõtet. Peamised pendlit asendavad tegurid on happe kontsentratsioon ja metalli aktiivsus. Lihtsuse huvides kasutame 3 tüüpi happe kontsentratsiooni: kontsentreeritud (üle 30%), lahjendatud (30%või vähem), väga lahjendatud (alla 5%). Me jagame metallid nende aktiivsuse järgi aktiivseteks (enne alumiiniumi), keskmise aktiivsusega (alumiiniumist vesinikuks) ja mitteaktiivseteks (pärast vesinikku). Me korraldame lämmastikhappe redutseerimisprodukte oksüdatsiooniastme vähenemise järjekorras:
NO 2; EI; N20; N2; NH4NO3
Mida aktiivsem on metall, seda rohkem liigume paremale. Mida suurem on happe kontsentratsioon või väiksem lahjendusaste, seda rohkem liigume vasakule.
Näiteks , kontsentreeritud hape ja mitteaktiivne metall vask Cu interakteeruvad. Järelikult liigume vasakpoolsesse asendisse, tekib lämmastikoksiid (IV), vasenitraat ja vesi.
Metallide koostoime väävelhappega
Lahjendatud väävelhape reageerib metallidega nagu tavaline mineraalhape. Need. interakteerub metallidega, mis paiknevad vesinikule elektrokeemiliste pingete jadas. Oksüdeerivaks aineks on siin H + ioonid, mis on redutseeritud molekulaarseks vesinikuks H 2. Sellisel juhul oksüdeeritakse metallid reeglina minimaalne oksüdatsiooni olek.
Näiteks:
Fe + H 2 SO 4 (lahjendatud) = FeSO 4 + H 2
interakteerub metallidega pingete seerias nii enne kui ka pärast vesinikku.
H 2 SO 4 (konts) + metall = metallisool + väävlit taandav toode (SO 2, S, H 2 S) + vesi
Kui kontsentreeritud väävelhape interakteerub metallidega, moodustub (stabiilses oksüdatsiooniasendis) metallisool, vesi ja väävli redutseeriv toode - vääveldioksiid S +4 O 2, molekulaarne väävel S või vesiniksulfiid H 2 S -2, sõltuvalt metalli kontsentratsiooniastmest, aktiivsusest, selle jahvatusastmest, temperatuurist jne. Kui kontsentreeritud väävelhape interakteerub metallidega, ei teki molekulaarset vesinikku!
Kontsentreeritud väävelhappe ja metallide koostoime põhiprintsiibid:
1. Kontsentreeritud väävelhape passiveerib alumiinium, kroom, raud toatemperatuuril või külmas;
2. Kontsentreeritud väävelhape ei suhtle koos kuld, plaatina ja pallaadium ;
3. KOOS mitteaktiivsed metallid kontsentreeritud väävelhape toibub vääveloksiid (IV).
Näiteks, vask oksüdeeritakse kontsentreeritud väävelhappega:
Cu 0 + 2H2S +6O4 (konts) = Cu +2SO4 + S +4O2 + 2H20
4. Suhtlemisel aktiivsete metallide ja tsingiga moodustub kontsentreeritud väävelhapeväävel S või vesiniksulfiid H 2 S 2- (sõltuvalt temperatuurist, jahvatusastmest ja metalli aktiivsusest).
Näiteks , kontsentreeritud väävelhappe ja tsingi koostoime:
8Na 0 + 5H 2 S + 6 O 4 (konts) → 4Na 2 + SO 4 + H 2 S — 2 + 4H 2O
Vesinikperoksiidi
Vesinikperoksiid H 2 O 2 sisaldab hapnikku -1 oksüdatsiooni olekus. Selline hapnik võib oksüdatsiooni olekut nii suurendada kui ka vähendada. Seega ilmneb vesinikperoksiid ning oksüdeerivad ja redutseerivad omadused.
Redutseerivate ainetega suhtlemisel avaldab vesinikperoksiid oksüdeeriva aine omadusi ja taandub oksüdatsiooniasendisse -2. Reeglina on vesinikperoksiidi redutseerimise produktiks sõltuvalt reaktsioonitingimustest vesi või hüdroksiidioon. Näiteks:
S +4 O 2 +H 2 O 2 -1 → H 2 S +6 O 4 -2
Oksüdeerijatega suheldes oksüdeeritakse peroksiid molekulaarseks hapnikuks (oksüdatsiooniaste 0): O 2. Näiteks :
2KMn +7 O 4 + 5H 2 O 2 -1 + 3H 2 SO 4 → 5O 2 0 + 2Mn +2 SO 4 + K 2 SO 4 + 8H 2O
Keemilisi reaktsioone, mis toimuvad reagentide moodustavate elementide oksüdatsiooniseisundi muutumisega, nimetatakse redoksiks.
Oksüdeerimine on aatomist, molekulist või ioonist elektronide annetamise protsess. Kui aatom annetab oma elektronid, omandab ta positiivse laengu, näiteks:
Kui näiteks negatiivselt laetud ioon (laeng -1) annetab 1 elektroni, muutub see neutraalseks aatomiks:
![]()
Kui positiivselt laetud ioon või aatom annetab elektrone, suureneb selle positiivse laengu väärtus vastavalt annetatud elektronide arvule:

Redutseerimine on elektronide kinnitamine aatomi, molekuli või iooni külge.
Kui aatom kinnitab elektronid, muutub see negatiivselt laetud iooniks:

Kui positiivselt laetud ioon võtab vastu elektrone, väheneb selle laengu väärtus, näiteks:

või võib see minna neutraalsele aatomile:

Oksüdeeriv aine on aatom, molekul või ioon, mis võtab vastu elektrone. Redutseeriv aine on aatom, molekul või ioon, mis annetab elektrone.
Reaktsiooni käigus oksüdeeriv aine redutseeritakse ja redutseerija oksüdeeritakse.
Tuleb meeles pidada, et oksüdatsiooni (redutseerimise) käsitlemine elektronide andmise (ja vastuvõtmise) protsessina aatomite või ioonide poolt ei peegelda alati tegelikku olukorda, kuna paljudel juhtudel ei toimu elektronide täielikku ülekannet, vaid ainult elektronide pilve nihkumine ühest aatomist teise.
Redoksreaktsioonide võrrandite koostamisel ei ole aga oluline, milline side sel juhul moodustub - ioonne või kovalentne. Seetõttu räägime lihtsuse huvides elektronide kinnitumisest või vabanemisest, sõltumata sideme tüübist.
Redoksreaktsioonide võrrandite koostamine ja koefitsientide valimine. Redoksreaktsiooni võrrandi koostamisel on vaja kindlaks määrata redutseerija, oksüdeerija ja antud ning vastuvõetud elektronide arv.
Reeglina valitakse koefitsiendid kas elektroonilise tasakaalu meetodi või elektron-ioonide tasakaalu meetodi abil (mõnikord nimetatakse viimast poolreaktsiooni meetodiks).
Redoksreaktsioonide võrrandite koostamise näitena kaaluge püriidi oksüdeerimise protsessi kontsentreeritud lämmastikhappega:
Kõigepealt määratleme reaktsioonisaadused. on tugev oksüdeeriv aine, seetõttu väävel oksüdeerub maksimaalseks oksüdeerumiseks ja raud - kuni, samal ajal kui seda saab redutseerida või. Me valime.
Kus see asub (vasakul või paremal küljel), me veel ei tea.
1. Rakendame kõigepealt elektron-ioonide tasakaalu meetodit. See meetod arvestab elektronide üleminekut ühelt aatomilt või ioonilt teisele, võttes arvesse keskkonna (happeline, aluseline või neutraalne) olemust, milles reaktsioon toimub. - Oksüdeerimis- ja redutseerimisprotsesside võrrandite koostamisel tuleb vesiniku ja hapniku aatomite arvu võrdsustamiseks kas veemolekulid ja vesinikioonid (kui keskkond on happeline) või veemolekulid ja hüdroksiidioonid (kui keskkond on aluseline). kasutusele võetud (sõltuvalt meediumist). Sellest tulenevalt sisaldavad saadud tooted elektroonilise ioonvõrrandi paremal küljel vesinikioone ja veemolekule (happeline keskkond) või hüdroksiidioone ja veemolekule (leeliseline keskkond).
Seega tuleb elektroonilis-ioonvõrrandeid kirjutades lähtuda lahuses tegelikult esinevate ioonide koostisest. Lisaks, nagu ka lühendatud ioonvõrrandite koostamisel, tuleks halvasti dissotsieerunud, halvasti lahustuvad või gaasi kujul eralduvad ained kirjutada molekulaarsel kujul.
Vaatleme oma juhtumi puhul oksüdatsiooni poolreaktsiooni.
Molekul muutub iooniks, dissotsieerub täielikult ioonideks, me jätame tähelepanuta hüdrolüüsi) ja kaks iooni (dissotsiatsioon):
Hapniku võrdsustamiseks lisage 8 molekuli vasakule ja 16 iooni paremale küljele (keskkond on happeline!):
Vasakpoolne laeng on 0, parempoolne laeng peaks seega loobuma 15 elektronist:
Vaatleme nüüd nitraatioonide redutseerimise poolreaktsiooni:
![]()
Aatomist O. on vaja lahutada. Selleks lisage vasakule küljele 4 iooni (happeline keskkond) ja paremale - 2 molekuli
Laengu võrdsustamiseks lisage vasakule 3 elektroni (laeng):
Lõpuks on meil:

Mõlema osa vähendamisel saame redoksreaktsiooni lühendatud ioonvõrrandi:
Lisades võrrandi mõlemale poolele vastava arvu ioone, leiame reaktsiooni molekulaarvõrrandi:
Pange tähele, et antud ja vastuvõetud elektronide hulga määramiseks ei pidanud me kunagi elementide oksüdatsiooni olekut kindlaks määrama. Lisaks võtsime arvesse keskkonna mõju ja määrasime automaatselt, mis asub võrrandi paremal küljel. Pole kahtlust, et see meetod on keemilise tähendusega palju paremini kooskõlas kui tavaline elektrooniline tasakaalumeetod, kuigi viimast on mõnevõrra lihtsam mõista.
2. Võrdsime selle reaktsiooni elektroonilise tasakaalu meetodil. Taastamisprotsessi kirjeldatakse lihtsalt:
Oksüdeerimisskeemi koostamine on keerulisem, kuna 2 elementi oksüdeeruvad korraga - Fe ja S. Saate seostada väävli oksüdeerumise oleku rauaga ja arvestada, et 1 Fe aatomi kohta on kaks S -aatomit:

Siiski on võimalik loobuda oksüdatsiooniastmete määramisest ja kirjutada skeem (7.1), mis sarnaneb:
Paremal küljel on laeng +15, vasakul - 0, seega peab see annetama 15 elektroni. Kirjutame üldise saldo üles:

5 molekuli läheb oksüdeerimiseks ja moodustumiseks on vaja veel 3 molekuli
Vesiniku ja hapniku võrdsustamiseks lisage paremale küljele 2 molekuli:
Elektroonioonide tasakaalustamise meetod on mitmekülgsem kui elektrooniline tasakaalumeetod ja sellel on vaieldamatu eelis koefitsientide valimisel paljudes redoksreaktsioonides, eriti orgaaniliste ühendite osavõtul, kusjuures isegi oksüdatsiooniastmete määramise protseduur on väga keeruline.
Mõelge näiteks etüleeni oksüdeerumisele, mis toimub siis, kui see lastakse läbi kaaliumpermanganaadi vesilahuse. Selle tulemusena oksüdeeritakse etüleen etüleenglükooliks ja permanganaat redutseeritakse mangaan (IV) oksiidiks, lisaks, nagu ilmneb lõppbilansi võrrandist, moodustub paremal ka kaaliumhüdroksiid:

Pärast selliste terminite vajalike taandamiste tegemist kirjutame võrrandi lõplikku molekulaarsesse vormi
Redoksreaktsioonide kvantitatiivsed omadused. Valik standardseid elektroodipotentsiaale. Mis tahes redoksreaktsiooni tekkimise võimalus reaalsetes tingimustes on tingitud mitmest põhjusest: temperatuur, oksüdeeriva ja redutseeriva aine olemus, keskkonna happesus, reaktsioonis osalevate ainete kontsentratsioon jne.
Kõigi nende tegurite arvessevõtmine võib olla keeruline, kuid pidades meeles, et igasugune redoksreaktsioon toimub elektronide ülekandmisel redutseerijalt oksüdeerivale ainele, on võimalik kehtestada sellise reaktsiooni võimalikkuse kriteerium. .
Redoksprotsesside kvantitatiivseks tunnuseks on oksüdeerijate ja redutseerivate ainete (või standardsete elektroodipotentsiaalide) normaalsed redokspotentsiaalid.
Selliste potentsiaalide füüsikalis-keemilise tähenduse mõistmiseks on vaja analüüsida nn elektrokeemilisi protsesse.
Keemilisi protsesse, millega kaasneb elektrivoolu ilmumine või mis on selle põhjustatud, nimetatakse elektrokeemilisteks.
Elektrokeemiliste protsesside olemuse mõistmiseks vaatleme mitmeid üsna lihtsaid olukordi. Kujutage ette metallplaati, mis on vette kastetud. Polaarsete veemolekulide toimel eralduvad metalliioonid plaadi pinnalt ja hüdreerituna lähevad vedelasse faasi. Sel juhul laetakse viimane positiivselt ja metallplaadile ilmub elektronide liig. Mida protsess edasi, seda suuremaks muutub nii plaadi kui ka vedelfaasi laeng.
Lahuskatioonide ja liigsete metallide elektronide elektrostaatilise tõmbe tõttu ilmub liidesele nn elektriline topeltkiht, mis pärsib metalliioonide edasist üleminekut vedelasse faasi. Lõpuks saabub hetk, mil lahuse ja metallplaadi vahel on saavutatud tasakaal, mida saab väljendada võrrandiga:
või võttes arvesse lahuses olevate ioonide hüdratatsiooni:
Selle tasakaalu olek sõltub metalli olemusest, selle ioonide kontsentratsioonist lahuses, temperatuurist ja rõhust.
Kui metalli sukeldatakse mitte vette, vaid selle metalli soola lahusesse, nihkub tasakaal vastavalt Le Chatelieri põhimõttele vasakule ja seda enam, seda suurem on metalliioonide kontsentratsioon lahuses. Aktiivsed metallid, mille ioonidel on hea võime lahustuda, laetakse sel juhul negatiivselt, ehkki vähemal määral kui puhtas vees.
Tasakaalu (7.2) saab paremale nihutada, kui elektronid ühel või teisel viisil metallilt eemaldada. See lahustab metallplaadi. Vastupidi, kui metallplaadile tarnitakse elektrone väljastpoolt, toimub ioonide sadestumine lahusest sellele.
Nagu juba märgitud, tekib metalli lahusesse kastmisel liidesele elektriline kahekihiline kiht. Metalli ja ümbritseva vedela faasi vahel tekkivat potentsiaalset erinevust nimetatakse elektroodipotentsiaaliks. See potentsiaal on iseloomulik metalli redoksvõimsusele tahke faasi kujul.
Pange tähele, et isoleeritud metalli aatomi (üheaatomilise auru olek, mis tekib kõrgel temperatuuril ja kõrgel haruldasusel) korral iseloomustab redoksomadusi erinev kogus, mida nimetatakse ionisatsioonipotentsiaaliks. Ionisatsioonipotentsiaal on energia, mis on vajalik elektroni eraldamiseks isoleeritud aatomist.
Elektroodi potentsiaali absoluutväärtust ei saa otse mõõta. Samal ajal ei ole raske mõõta elektroodipotentsiaalide erinevust, mis tekib süsteemis, mis koosneb kahest metalli-lahuse paarist. Selliseid paare nimetatakse pool-elementideks. Leppisime kokku metallide elektroodipotentsiaalide määramise seoses nn standardse vesinikuelektroodiga, mille potentsiaali võetakse meelevaldselt nulliks. Standardne vesinikuelektrood koosneb spetsiaalselt valmistatud plaatinaplaadist, mis on sukeldatud happelahusesse vesinikioonide kontsentratsiooniga ja gaasilise vesinikujoaga rõhul Pa temperatuuril
Potentsiaali tekkimist tavalise vesinikuelektroodi juures võib ette kujutada järgmiselt. Gaasiline vesinik, mida adsorbeerib plaatina, läheb aatomi olekusse:
![]()
Plaadi pinnale tekkinud aatomvesiniku, lahuses olevate vesinikioonide ja plaatina (elektronid!) Vahel tekib dünaamilise tasakaalu seisund:
![]()
Kogu protsessi väljendab võrrand:
![]()
Plaatina ei osale redoksprotsessis, vaid on ainult aatomvesiniku kandja.
Kui metallplaat, mis on sukeldatud selle soola lahusesse metalliioonide kontsentratsiooniga 1 mol / l, on ühendatud standardse vesinikuelektroodiga, saate galvaanilise elemendi. Selle elemendi (EMF) elektromotoorjõud, mõõdetuna ja iseloomustades metalli standardset elektroodipotentsiaali, mida tavaliselt tähistatakse kui.
Tabelis 7.1 on toodud mõnede metallide standardsete elektroodipotentsiaalide väärtused. Elektroodide standardpotentsiaalidel, mis toimivad vesiniku suhtes redutseerijatena, on „-“ märk ja „+“ tähistab oksüdeerivateks elektroodide standardpotentsiaali.
Metallid, mis on paigutatud nende elektroodipotentsiaalide kasvavas järjekorras, moodustavad metallipingete nn elektrokeemilise seeria:
Metallide keemilisi omadusi iseloomustavad mitmed pinged:
1. Mida negatiivsem on metalli elektroodipotentsiaal, seda suurem on selle taandatavus.
2. Iga metall on võimeline soolalahustest välja tõrjuma (vähendama) neid metalle, mis on pärast seda metallipingete elektrokeemilises seerias.
3. Kõik metallid, millel on negatiivne standardne elektroodipotentsiaal, st E. need, kes kuuluvad vesinikust vasakule jäävate metallipingete elektrokeemiliste seeriate hulka, suudavad selle happelistest lahustest välja tõrjuda.
Tuleb märkida, et esitatud seeria iseloomustab metallide ja nende soolade käitumist ainult vesilahustes ja toatemperatuuril. Lisaks tuleb arvestada, et tabelis näidatud standardsete elektroodipotentsiaalidega arvestatakse ühe või teise iooni ja lahusti molekulidega interaktsiooni iseärasusi. See võib rikkuda mõningaid eeldatavaid mustreid metallipingete elektrokeemilise seeria metallide paigutuses. Näiteks metallide elektrokeemiline pingeseeria algab liitiumiga, samas kui keemiliselt aktiivsem rubiidium ja kaalium asuvad liitiumist paremal. Selle põhjuseks on liitiumioonide hüdratatsiooniprotsessi äärmiselt suur energia võrreldes teiste leelismetallide ioonidega.
Samal ajal on tabelis 7.1 loetletud standardsed redokspotentsiaalid, mida mõõdeti tüüpi (7.3) mittemetalliliste süsteemide puhul, mis on normaalse vesinikuelektroodi suhtes tasakaalus.
Tabelis on näidatud järgmise üldvormi vähendavad poolreaktsioonid:
Nagu metallide väärtuse määramisel, mõõdetakse mittemetallide väärtusi temperatuuril 25 ° C ja kõigi tasakaalus osalevate aatomite ja molekulaarsete osakeste kontsentratsioonis 1 mol / l.
Tabel 7.1. Standardne redokspotentsiaal temperatuuril 25 ° C (298 K)
(vt skannimist)
Standardse redokspotentsiaali algebraline väärtus iseloomustab vastava oksüdeeritud vormi oksüdatiivset aktiivsust. Seetõttu võimaldab standardsete redokspotentsiaalide väärtuste võrdlus vastata küsimusele: kas see või teine redoksreaktsioon toimub?
Seega kõik halogeniidioonide oksüdeerumise poolreaktsioonid vabadeks halogeenideks

võib teostada standardtingimustes, kasutades oksüdeerijana plii (IV) oksiidi või kaaliumpermanganaati. Kaaliumdikromaadi kasutamisel võib läbi viia ainult reaktsioone (7.5) ja (7.6). Lõpuks võimaldab lämmastikhappe kasutamine oksüdeerijana läbi viia ainult poolreaktsiooni, milles osalevad ka jodiidioonid (7.6).
Seega on konkreetse redoksreaktsiooni võimalikkuse hindamise kvantitatiivseks kriteeriumiks oksüdatsiooni ja redutseerimise poolreaktsioonide standardsete redokspotentsiaalide vahe positiivne väärtus.
TEOORILISE KEEMIA ALUSED
10. Redoxi reaktsioonid
Redoksreaktsioonid lahustes.
Keemilisi reaktsioone, mis toimuvad reagentide moodustavate elementide oksüdatsiooniseisundi muutumisega, nimetatakse redoksiks.
Oksüdeerimine
- see on aatomite, molekulide või ioonide poolt elektronidest loobumise protsess. Kui aatom annetab oma elektronid, omandab ta positiivse laengu: l - , annetab 1 elektroni, siis muutub see neutraalseks aatomiks:![]()
Kui positiivselt laetud ioon või aatom annetab elektrone, suureneb selle positiivse laengu väärtus vastavalt annetatud elektronide arvule:

Redutseerimine on elektronide kinnitamine aatomi, molekuli või iooni külge.
Kui aatom seob elektronid, siis muutub see negatiivselt laetud iooniks:

Kui positiivselt laetud ioon võtab vastu elektrone, väheneb selle laengu väärtus:

või võib see minna neutraalsele aatomile:

Oksüdeeriv aine
elektronide vastuvõtmine. Taastaja on aatom, molekul või ioon, elektronide annetamine.Oksüdeeriv aine
reaktsiooni käigus redutseeritud, redutseerija - oksüdeeritud.Tuleb meeles pidada, et oksüdatsiooni (redutseerimise) käsitlemine elektronide andmise (ja vastuvõtmise) protsessina aatomite või ioonide poolt ei peegelda alati tegelikku olukorda, kuna paljudel juhtudel ei toimu elektronide täielikku ülekannet, vaid ainult elektronide pilve nihkumine ühest aatomist teise.
Redoksreaktsioonide võrrandite koostamisel ei ole aga oluline, milline side sel juhul moodustub - ioonne või kovalentne. Seetõttu räägime lihtsuse huvides elektronide kinnitumisest või vabanemisest, sõltumata sideme tüübist.
Stöhhiomeetriliste koefitsientide määramine redoksreaktsioonide võrrandites. Redoksreaktsiooni võrrandi koostamisel on vaja kindlaks määrata redutseerija, oksüdeerija ja antud ning vastuvõetud elektronide arv. Reeglina valitakse koefitsiendid kas meetodi abil elektrooniline tasakaal
, kumbki meetod elektron-ioonide tasakaal (mõnikord nimetatakse viimast meetodiks poolreaktsioonid ).Redoksreaktsioonide võrrandite koostamise näitena kaaluge püriidi oksüdeerimise protsessi kontsentreeritud lämmastikhappega.
Kõigepealt määratleme reaktsioonisaadused.
HNO 3 on tugev oksüdeeriv aine, seetõttu väävel oksüdeerub maksimaalse oksüdeerumisastmeni S 6+ ja raud - kuni Fe 3+, samas kui HNO 3 võib taastuda kuni EI või EI 2. Valime EI:Kus see saab olema
H20 (vasakul või paremal küljel), me ei tea veel.1. Esmalt kandideerime elektronioonide tasakaalu meetod
(poolreaktsioonid). See meetod arvestab elektronide üleminekut ühelt aatomilt või ioonilt teisele, võttes arvesse keskkonna (happeline, aluseline või neutraalne) olemust, milles reaktsioon toimub.Oksüdeerimis- ja redutseerimisprotsesside võrrandite koostamisel lisatakse vesiniku ja hapniku aatomite arvu võrdsustamiseks kas veemolekulid ja vesinikioonid (olenevalt keskkonnast) (kui keskkond on happeline), või veemolekulid ja hüdroksiidioonid (kui keskkond on aluseline). Sellest tulenevalt sisaldavad saadud tooted elektroonilise ioonvõrrandi paremal küljel vesinikioone ja veemolekule (happeline keskkond) või hüdroksiidioone ja veemolekule (leeliseline keskkond).
St. elektrooniliste ioonvõrrandite kirjutamisel tuleb lähtuda lahuses tegelikult esinevate ioonide koostisest. Lisaks, nagu lühendatud ioonvõrrandite koostamisel, on ained halvasti dissotsieerunud, halvasti lahustuvad või eralduvad gaasina tuleb kirjutada molekulaarsel kujul.
Vaatleme oma juhtumi puhul oksüdatsiooni poolreaktsiooni. Molekul
FeS 2 muutub Fe iooniks 3+ (F е (N О 3) 3 dissotsieerub täielikult ioonideks, jätame hooletusse hüdrolüüsi) ja kaheks iooniks SO 4 2 - (H 2 SO 4 dissotsiatsioon):Hapniku võrdsustamiseks lisage vasakule 8 H molekuli
2 O ja paremale - 16 H iooni+ (happeline keskkond):Vasakpoolne laeng on 0, parempoolne laeng +15, seega
FeS 2 peaks annetama 15 elektroni:Vaatleme nüüd nitraatioonide redutseerimise poolreaktsiooni:
![]()
Tuleb ära võtta
N O 3 2 o aatomit. Selleks lisage vasakule küljele 4 Н iooni 1+ (happeline keskkond) ja paremale - 2 molekuli H 2 Teave:Laengu võrdsustamiseks vasakule poole (laeng
+3) lisage 3 elektroni:Lõpuks on meil:

Mõlema osa vähendamine 16N võrra
+ ja 8H2 Oh, saame redoksreaktsiooni lühendatud ioonvõrrandi:Lisades võrrandi mõlemale poolele vastava arvu ioone
EI 3 - ja H + leiame reaktsiooni molekulaarse võrrandi:Pange tähele, et antud ja vastuvõetud elektronide hulga määramiseks ei pidanud te kunagi elementide oksüdatsiooni olekut kindlaks määrama. Lisaks võtsime arvesse keskkonna mõju ja tegime automaatselt kindlaks, et H
2 O on võrrandi paremal küljel. Pole kahtlust, et see meetod palju rohkem kooskõlas keemilise tähendusega kui tavaline elektrooniline tasakaalustusmeetod, kuigi viimast on mõnevõrra lihtsam mõista.2. Võrdsime selle reaktsiooni meetodiga elektrooniline tasakaal ... Taastamisprotsessi kirjeldatakse järgmiselt:
![]()
Oksüdeerimisskeemi koostamine on keerulisem, kuna kaks elementi oksüdeeritakse korraga -
Fe ja S. Oksüdeerimisoleku saate seostada rauaga 2+, väävliga 1- ja arvestada sellega, et Fe-aatomi kohta on kaks S-aatomit:
Siiski on võimalik loobuda oksüdatsiooniastmete määramisest ja kirjutada skeem, mis sarnaneb skeemiga
![]()
Paremal küljel on laeng +15, vasakul - 0, seega
FeS 2 peaks annetama 15 elektroni. Kirjutame üldise saldo üles:
viis HNO molekuli
3 mine oksüdatsioonile FeS 2, ja veel kolm molekuli HNO 3 hariduse jaoks hädavajalik Fe (NO 3) 3:Vesiniku ja hapniku võrdsustamiseks lisame paremale küljele kaks molekuli H
2 Teave:Elektrooniliste ioonide tasakaalu meetod on elektroonilise tasakaalu meetodiga võrreldes universaalsem ja sellel on koefitsientide valimisel vaieldamatu eelis
sisse paljusid redoksreaktsioone, eelkõige orgaaniliste ühendite osavõtul, mille puhul isegi oksüdatsiooniseisundite määramise protseduur on väga keeruline.Mõelge näiteks etüleeni oksüdeerumisele, mis toimub siis, kui see lastakse läbi kaaliumpermanganaadi vesilahuse. Selle tulemusena oksüdeeritakse etüleen etüleenglükooliks HO-
CH2 - CH2 -OH ja permanganaat redutseeritakse mangaan (IV) oksiidiks, lisaks, nagu ilmneb lõppbilansi võrrandist, moodustub paremal ka kaaliumhüdroksiid:
Pärast selliste terminite vajalike taandamiste tegemist kirjutame võrrandi lõplikku molekulaarsesse vormi
Redoksreaktsioonide standardsed võimalused.
Mis tahes redoksreaktsiooni võimalus reaalsetes tingimustes on tingitud mitmest põhjusest: temperatuur, oksüdeeriva ja redutseeriva aine olemus, keskkonna happesus, reaktsioonis osalevate ainete kontsentratsioon jne. kõiki neid tegureid on raske arvesse võtta, kuid pidades meeles, et mis tahes redoksreaktsioon toimub elektronide ülekandmisel redutseerijalt oksüdeerivale ainele, saab sellise reaktsiooni võimalikkuse kriteeriumi kindlaks määrata.Redoksprotsesside kvantitatiivsed omadused on oksüdeerijate ja redutseerijate normaalne redokspotentsiaal (või standardpotentsiaalid elektroodid).
Selliste potentsiaalide füüsikalis-keemilise tähenduse mõistmiseks on vaja analüüsida nn elektrokeemilisi protsesse.
Keemilisi protsesse, millega kaasneb elektrivoolu ilmumine või mis on selle põhjustatud, nimetatakse elektrokeemilisteks.
Elektrokeemiliste protsesside olemuse mõistmiseks vaatleme mitmeid üsna lihtsaid olukordi. Kujutage ette metallplaati, mis on vette kastetud. Polaarsete veemolekulide toimel eralduvad metalliioonid plaadi pinnalt ja hüdreerituna lähevad vedelasse faasi. Sel juhul laetakse viimane positiivselt ja metallplaadile ilmub elektronide liig. Mida protsess edasi, seda suuremaks laeng muutub.
, nii plaat kui ka vedel faas.Lahuskatioonide ja liigsete metallide elektronide elektrostaatilise tõmbe tõttu ilmub liidesele nn elektriline topeltkiht, mis pärsib metalliioonide edasist üleminekut vedelasse faasi. Lõpuks saabub hetk, mil lahuse ja metallplaadi vahel on saavutatud tasakaal, mida saab väljendada järgmise võrrandiga:
või võttes arvesse lahuses olevate ioonide hüdratatsiooni:
Selle tasakaalu olek sõltub metalli olemusest, selle ioonide kontsentratsioonist lahuses, temperatuurist ja
surve.Kui metalli sukeldatakse mitte vette, vaid selle metalli soola lahusesse, nihkub tasakaal vastavalt Le Chatelieri põhimõttele vasakule ja seda enam, seda suurem on metalliioonide kontsentratsioon lahuses. Aktiivsed metallid, mille ioonidel on hea võime lahustuda, laetakse sel juhul negatiivselt, ehkki vähemal määral kui puhtas vees.
Tasakaalu saab paremale nihutada, eemaldades metallid ühel või teisel viisil elektronidelt. See lahustab metallplaadi. Vastupidi, kui metallplaadile tarnitakse väljastpoolt elektrone, siis sellele sadenevad ioonid
alates lahendus.Kui metall on lahusesse kastetud, moodustub liideses kahekordne elektriline kiht. Metalli ja ümbritseva vedela faasi vahel tekkivat potentsiaalset erinevust nimetatakse elektroodipotentsiaaliks. See potentsiaal on iseloomulik metalli redoksvõimsusele tahke faasi kujul.
Eraldatud metalli aatomis (monatoomilise auru olek, mis tekib kõrgel temperatuuril ja kõrgel haruldusastmel) iseloomustab redoksomadusi teine kogus, mida nimetatakse ionisatsioonipotentsiaaliks. Ionisatsioonipotentsiaal on energia, mis on vajalik elektroni eraldamiseks isoleeritud aatomist.
Elektroodi potentsiaali absoluutväärtust ei saa otse mõõta. Samal ajal ei ole raske mõõta elektroodipotentsiaalide erinevust, mis tekib süsteemis, mis koosneb kahest metalli-lahuse paarist. Selliseid paare nimetatakse poolrakud ... Leppisime kokku metallide elektroodipotentsiaalide määramise seoses nn standardse vesinikuelektroodiga, mille potentsiaali võetakse meelevaldselt nulliks. Standardne vesinikuelektrood koosneb spetsiaalselt valmistatud plaatinaplaadist, mis on kastetud happelisse lahusesse vesinikioonide kontsentratsiooniga 1 mol / l ja pestud gaasilise vesiniku vooluga rõhul 10
5 Pa, temperatuuril 25 ° C.Valik standardseid elektroodipotentsiaale.
Kui metallplaat, mis on sukeldatud selle soola lahusesse metalliioonide kontsentratsiooniga 1 mol / l, on ühendatud standardse vesinikuelektroodiga, saate galvaanilise elemendi. Selle elemendi (EMF) elektromotoorjõud, mõõdetuna temperatuuril 25 ° C, iseloomustab metalli standardne elektroodipotentsiaal, tähistatakse tavaliselt kui E °.Elektroodidel, mis toimivad redutseerijatena vesiniku suhtes, on potentsiaalsed potentsiaalid märgiga „-” ja „+” märgiga oksüdeerivad ained.
Metallid, mis on paigutatud nende elektroodipotentsiaalide kasvavas järjekorras, moodustavad nn metalli pingete elektrokeemiline seeria :Li, Rb, K, oh, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Metallide keemilisi omadusi iseloomustavad mitmed pinged:
1. Mida negatiivsem on metalli elektroodipotentsiaal, seda suurem on selle taandatavus.
2. Iga metall on võimeline soolalahustest välja tõrjuma (vähendama) neid metalle, mis on pärast seda metallipingete elektrokeemilises seerias.
3. Kõik metallid, millel on negatiivne standardelektroodipotentsiaal, st need, mis paiknevad vesinikust vasakule jäävate metallipingete elektrokeemilises seerias, on võimelised selle happelistest lahustest välja tõrjuma.
Nagu metallide E ° väärtuse määramisel, mõõdetakse mittemetallide E ° väärtusi temperatuuril 25 ° C ja kõigi tasakaalus osalevate aatomite ja molekulaarsete osakeste kontsentratsioonil 1 mol / l.
Standardse redokspotentsiaali algebraline väärtus iseloomustab vastava oksüdeeritud vormi oksüdatiivset aktiivsust. Sellepärast Tavaliste redokspotentsiaalide väärtuste võrdlus võimaldab meil vastata küsimusele: kas see või teine redoksreaktsioon toimub?
Konkreetse redoksreaktsiooni võimalikkuse hindamise kvantitatiivne kriteerium on oksüdatsiooni ja redutseerimise poolreaktsioonide standardsete redokspotentsiaalide erinevuse positiivne väärtus.
Lahuste elektrolüüs.
Redoksreaktsioonide kogumit, mis tekivad lahustel või sula elektrolüütidel elektroodidel, kui nende kaudu elektrivool läbi lastakse, nimetatakse elektrolüüsiks.Vooluallika katoodil toimub elektronide ülekandmine lahusest või sulamist katioonidesse, seetõttu katood on "redutseerija". Seetõttu toimub anoodil elektronide vabanemine anioonide poolt anood on “oksüdeeriv aine”.
Elektrolüüsi ajal võivad konkureerivad protsessid toimuda nii anoodil kui ka katoodil.
Kui elektrolüüs viiakse läbi inertse (mittetarbitava) anoodi (näiteks grafiidi või plaatina) abil, konkureerivad reeglina kaks oksüdeerimis- ja kaks redutseerimisprotsessi:
anoodil - anioonide ja hüdroksiidioonide oksüdeerimine,
katoodil - katioonide ja vesinikioonide redutseerimine.
Elektrolüüsi teostamisel aktiivse (tarbitava) anoodi abil on protsess keeruline ja konkureerivad reaktsioonid elektroodidel on järgmised:
anoodi juures - anioonide ja hüdroksiidioonide oksüdeerimine, metalli - anoodmaterjali anoodne lahustamine;
katoodil - soolakatiooni ja vesinikioonide redutseerimine, metallkatioonide redutseerimine, mis saadakse anoodi lahustamisel.
Valides anoodi ja katoodi juures kõige tõenäolisemat protsessi, tuleks lähtuda sellest positsioonist, et reaktsioon toimub, mille jaoks on vaja kõige vähem energiatarbimist. Lisaks kasutatakse anoodi ja katoodi kõige tõenäolisema protsessi valimiseks inertse elektroodiga elektrolüüsi ajal järgmisi reegleid:
Anoodil võivad moodustada järgmised tooted: a) anioone F sisaldavate lahuste elektrolüüsi ajal -, SO 4 2-, N Umbes 3 - , RO 4 3 - , samuti leeliste lahused, eraldub hapnik; b) C anioonide oksüdeerumisel l - , B r -, mina-vabanevad vastavalt kloor, broom, jood;c) orgaaniliste hapete anioonide oksüdeerumisel toimub protsess:2. Ioonid sisaldavate soolalahuste elektrolüüsil, mis paiknevad pingetest Al -st vasakul
3+ , katoodist eraldub vesinik; kui ioon paikneb vesinikust paremal asuvas pingejadas, vabaneb katoodil metall.3. Ioonide sisaldavate soolade lahuste elektrolüüsil, mis asuvad pingejada vahel
Al + ja H + , katoodil võivad toimuda konkureerivad protsessid nii katioonide redutseerimisel kui ka vesiniku eraldumisel.Vaatleme näitena vaskkloriidi vesilahuse elektrolüüsi inertsetel elektroodidel. Lahus sisaldab Cu ioone
2+ ja 2Сl - mis suunatakse elektrivoolu toimel vastavatele elektroodidele:
Katoodil vabaneb metalliline vask ja anoodil gaas kloor.
Kui vaadeldavas lahuse elektrolüüsi näites
CuCl 2 võtke anoodiks vaskplaat, seejärel vabaneb vask katoodil ja anoodil, kus toimuvad oksüdatsiooniprotsessid, selle asemel, et C -ioone tühjendada l - ja kloori vabanemine, anood (vask) oksüdeerub. Sel juhul toimub anoodi lahustumine ise ja Cu -ioonide kujulläheb lahendusse. Elektrolüüs CuCl 2 lahustuva anoodiga saab kirjutada järgmiselt:
Soolalahuste elektrolüüs lahustuva anoodiga taandatakse anoodimaterjali oksüdeerumiseni (selle lahustumiseni) ja sellega kaasneb metalli ülekandumine anoodilt katoodile. Seda omadust kasutatakse laialdaselt metallide puhastamisel (puhastamisel) saastumisest.
Sulakute elektrolüüs. Väga aktiivsete metallide (naatrium, alumiinium, magneesium, kaltsium jne) saamiseks, mis veega kergesti interakteeruvad, kasutatakse sula soolade või oksiidide elektrolüüsi:

Kui elektrivool lastakse läbi aktiivse metalli soola ja hapnikku sisaldava happe vesilahuse, siis ei välju ei metallkatioonid ega happejäägi ioonid. Katoodil vabaneb vesinik,
ja edasi anood on hapnik ja elektrolüüs taandub vee elektrolüütiliseks lagunemiseks.Elektrolüütide lahuste elektrolüüs on energeetiliselt soodsam kui sulamistel, kuna elektrolüüdid - soolad ja leelised - sulavad väga kõrgetel temperatuuridel.
Faraday elektrolüüsi seadus.
Elektrivoolu mõjul tekkinud aine koguse sõltuvust ajast, voolutugevusest ja elektrolüüdi olemusest saab kindlaks teha üldistatud põhjal Faraday seadus :kus T - elektrolüüsi käigus tekkinud aine mass (g); E on aine ekvivalentmass (g / mol); M on aine molaarmass (g / mol); NS- antud või vastuvõetud elektronide arv;
I - voolutugevus (A); t - protsessi kestus(koos); F - Faraday konstant,iseloomustab elektrienergia kogust, mis on vajalik 1 ekvivalentse massi aine vabastamiseks(F = 96 500 C / mol = 26,8 A × h / mol).Nende hulka kuuluvad reaktsioonid, mille käigus reageerivad ained vahetavad elektrone, muutes samal ajal reageerivaid aineid moodustavate elementide aatomite oksüdatsiooni olekut.
Näiteks:
Zn + 2H + → Zn 2+ + H 2,
FeS2 + 8HNO3 (konts) = Fe (NO3) 3 + 5NO + 2H2SO4 + 2H20,
Valdav enamus keemilistest reaktsioonidest on redoksreaktsioonid, neil on äärmiselt oluline roll.
Oksüdeerimine on aatomist, molekulist või ioonist elektronide annetamise protsess.
Kui aatom annetab oma elektronid, omandab ta positiivse laengu:
Näiteks:
Al - 3e - = Al 3+
H2-2e- = 2H +
Oksüdeerimine suurendab oksüdatsiooni.
Kui negatiivselt laetud ioon (laeng -1), näiteks Cl -loobub 1 elektronist, muutub see neutraalseks aatomiks:
2Cl - - 2e - = Cl2
Kui positiivselt laetud ioon või aatom annetab elektrone, suureneb selle positiivse laengu väärtus vastavalt annetatud elektronide arvule:
Fe 2+ - e - = Fe 3+
Redutseerimine on elektronide kinnitamine aatomi, molekuli või iooni külge.
Kui aatom kinnitab elektronid, muutub see negatiivselt laetud iooniks:
Näiteks:
Сl 2 + 2- = 2Сl -
S + 2e - = S 2-
Kui positiivselt laetud ioon võtab vastu elektrone, väheneb selle laengu väärtus:
Fe 3++ e- = Fe 2+
või võib see minna neutraalsele aatomile:
Fe 2+ + 2e- = Fe 0
Oksüdeeriv aine on aatom, molekul või ioon, mis võtab vastu elektrone. Redutseeriv aine on aatom, molekul või ioon, mis annetab elektrone.
Reaktsiooni käigus oksüdeeriv aine redutseeritakse, redutseerija oksüdeeritakse.
Oksüdeerimisega kaasneb alati redutseerimine ja vastupidi, redutseerimine on alati seotud oksüdatsiooniga, mida saab väljendada võrranditega:
Redutseerija - e - id Oksüdeeriv aine
Oksüdeerija + e - uc Redutseeriv aine
Seetõttu on redoksreaktsioonid kahe vastandliku protsessi - oksüdatsiooni ja redutseerimise - ühtsus
Kõige olulisemad redutseerivad ja oksüdeerivad ained
|
Redutseerivad ained |
Oksüdeerijad |
Metallid, vesinik, kivisüsi Vingugaas (II) CO Vesiniksulfiid H 2 S, vääveloksiid (IV) SO 2, väävelhape H 2 SO 3 ja selle soolad Vesinikjodiidhape HI, vesinikbromiidhape HBr, vesinikkloriidhape HCl Tina (II) kloriid SnCl 2, raud (II) sulfaat FeSO 4, mangaan (II) sulfaat MnSO 4, kroom (III) sulfaat Cr 2 (SO 4) 3 Lämmastikhape HNO 2, ammoniaak NH 3, hüdrasiin N 2 H 4, lämmastikoksiid (II) NO Fosforhape H 3 PO 3 Aldehüüdid, alkoholid, sipelg- ja oksaalhapped, glükoos Elektrolüüsi katood |
Halogeenid Kaaliumpermanganaat KMnO 4, kaaliummanganaat K 2 MnO 4, mangaan (IV) oksiid MnO 2 Kaaliumdikromaat K 2 Cr 2 O 7, kaaliumkromaat K 2 CrO 4 Lämmastikhape HNO 3 Hapnik O 2, osoon O 3, vesinikperoksiid Н 2 О 2 Väävelhape H 2 SO 4 (konts.), Seleenhape H 2 SeO 4 Vask (II) oksiid CuO, hõbe (I) oksiid Ag 2 O, plii (IV) oksiid PbO 2 Väärismetallide ioonid (Ag +, Au 3+ jne) Raud (III) kloriid FeCl 3 Hüpokloritid, kloraadid ja perkloraadid Tsarskaja viin, kontsentreeritud lämmastik- ja vesinikfluoriidhapete segu Elektrolüüsi anood |
Elektroonilise tasakaalu meetod.
ORR -i võrdsustamiseks kasutatakse mitmeid meetodeid, millest praegu kaalume ühte - elektroonilise saldo meetodit.
Kirjutame alumiiniumi ja hapniku vahelise reaktsiooni võrrandi:
Al + O 2 = Al 2 O 3
Ärge laske end selle võrrandi lihtsusest petta. Meie ülesanne on välja mõelda meetod, mis tulevikus võimaldab teil võrdsustada palju keerukamaid reaktsioone.
Mis siis on elektroonilise tasakaalu meetod? Tasakaal on võrdsus. Seetõttu tuleks elektronide arv, millest üks element loobub ja teine element selles reaktsioonis vastu võtab, muuta samaks. Esialgu tundub see kogus erinev, mis ilmneb alumiiniumi ja hapniku erinevatest oksüdatsiooniastmetest:
Al 0 + O 2 0 = Al 2 + 3 O 3 -2
Alumiinium annetab elektrone (omandab positiivse oksüdatsiooniseisundi) ja hapnik võtab vastu elektronid (omandab negatiivse oksüdatsiooniseisundi). Oksüdatsiooniastme +3 saamiseks peab alumiiniumiaatom annetama 3 elektroni. Hapniku molekul, et muutuda hapniku aatomiteks oksüdatsiooniastmega -2, peab vastu võtma 4 elektroni:
Al 0 - 3e- = Al +3
O 2 0 + 4e- = 2O -2
Antud ja vastuvõetud elektronide arvu võrdsustamiseks tuleb esimene võrrand korrutada 4 -ga ja teine 3 -ga. Selleks piisab annetatud ja vastuvõetud elektronide arvu liigutamisest ülemise ja alumise joone vastu, nagu on näidatud ülaltoodud skeem.
Kui nüüd paneme võrrandisse redutseerija (Al) ette leitud koefitsiendi 4 ja oksüdeeriva aine (O 2) ees leitud koefitsiendi 3, siis antud ja vastuvõetud elektronide arv võrdsustatakse ja muutub võrdseks 12. Elektrooniline tasakaal on saavutatud. On näha, et enne reaktsioonisaadust Al 2 O 3 on vaja tegurit 2. Nüüd on redoksreaktsiooni võrrand võrdne:
4Al + 3O 2 = 2Al 2 O 3
Kõik elektroonilise tasakaalu meetodi eelised avalduvad keerulisematel juhtudel kui alumiiniumi oksüdeerimine hapnikuga.
Näiteks tuntud "kaaliumpermanganaat" - kaaliumpermanganaat KMnO 4 - on tugev oksüdeeriv aine tänu oksüdeerimisolekus +7 olevale Mn aatomile. Isegi klooranioon Cl - annab sellele elektroni, muutudes klooriaatomiks. Mõnikord kasutatakse seda laboris kloori tootmiseks:
K + Mn +7 O 4 -2 + K + Cl - + H 2 SO 4 = Cl 2 0 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
Koostame elektroonilise tasakaalu skeemi:
Mn +7 +5e- = Mn +2
2Cl - - 2e- = Cl 2 0
Kaks ja viis on võrrandi peamised koefitsiendid, tänu millele on lihtne leida kõiki teisi koefitsiente. Enne Cl 2 peaksite panema koefitsiendi 5 (või 2 × 5 = 10 KСl ette) ja enne KMnO 4 - koefitsiendi 2. Kõik teised tegurid on seotud nende kahe teguriga. See on palju lihtsam kui lihtsalt numbrite sorteerimine.
2 KMnO 4 + 10KCl + 8H 2SO 4 = 5 Cl 2 + 2MnSO 4 + 6K 2 SO 4 + 8H 2O
K -aatomite arvu võrdsustamiseks (vasakul 12 aatomit) peate võrrandi paremale küljele K 2 SO 4 ette panema koefitsiendi 6. Lõpuks hapniku ja vesiniku võrdsustamiseks piisab, kui panna tegur 8 H 2 SO 4 ja H 2 O ees. Võrrandi saime lõplikul kujul.
Elektroonilise tasakaalu meetod, nagu näeme, ei välista redoksreaktsioonide võrrandites tavapärast koefitsientide valikut, kuid võib sellist valikut oluliselt hõlbustada.
Võrrandi koostamine vase reaktsiooniks pallaadium (II) nitraadi lahusega. Kirjutagem üles reaktsiooni alg- ja lõppainete valemid ning näitame muutusi oksüdatsioonitingimustes:
millest järeldub, et redutseerija ja oksüdeerija puhul on koefitsiendid võrdsed 1. Reaktsiooni lõppvõrrand:
Cu + Pd (NO 3) 2 = Cu (NO 3) 2 + Pd
Nagu näha, ei esine elektronid üldises reaktsioonivõrrandis.
Koostatud võrrandi õigsuse kontrollimiseks loendame iga elemendi aatomite arvu paremal ja vasakul küljel. Näiteks paremal küljel on 6 hapnikuaatomit, vasakul küljel on samuti 6 aatomit; pallaadium 1 ja 1; vask on samuti 1 ja 1. Niisiis, võrrand on õigesti koostatud.
Kirjutame selle võrrandi ioonsel kujul ümber:
Cu + Pd 2+ + 2NO 3 - = Cu 2+ + 2NO 3 - + Pd
Ja pärast samade ioonide vähendamist saame
Cu + Pd 2+ = Cu 2+ + Pd
Mangaan (IV) oksiidi ja kontsentreeritud vesinikkloriidhappe interaktsiooni reaktsioonivõrrandi koostamine
(selle reaktsiooni abil laboris saadakse kloor).
Kirjutame üles reaktsiooni alg- ja lõppainete valemid:
НCl + МnО 2 → Сl 2 + MnСl 2 + Н 2 О
Näitame aatomite oksüdatsiooniastmete muutumist enne ja pärast reaktsiooni:
See reaktsioon on redoks, kuna kloori ja mangaani aatomite oksüdatsiooniastmed muutuvad. НCl on redutseerija, MnО 2 on oksüdeeriv aine. Koostame elektroonilised võrrandid:

ja leidke redutseerija ja oksüdeeriva aine koefitsiendid. Need on vastavalt 2 ja 1. Koefitsient 2 (ja mitte 1) on seatud, kuna 2 klooriaatomit oksüdatsiooniastmega -1 annetavad 2 elektroni. See koefitsient on juba elektroonilises võrrandis:
2HCl + MnO 2 → Сl 2 + MnСl 2 + Н 2 О
Leiame teiste reagentide koefitsiendid. Elektroonilistest võrranditest on näha, et 2 mooli HCl kohta on 1 mol MnO2. Arvestades aga, et saadud kahekordse laenguga mangaanioonide sidumiseks on vaja veel 2 mooli hapet, tuleks redutseerija ette panna koefitsient 4. Siis osutub vesi 2 mooliks. Lõplik võrrand on
4НCl + МnО 2 = Сl 2 + MnСl 2 + 2Н 2 О
Võrrandi õigekirja kontrollimine võib piirduda ühe elemendi, näiteks kloori aatomite arvu loendamisega: 4 vasakul ja 2 + 2 = 4 paremal.
Kuna elektroonilise tasakaalu meetod kujutab reaktsioonivõrrandeid molekulaarsel kujul, tuleks need pärast koostamist ja kontrollimist kirjutada ioonkujul.
Kirjutame selle võrrandi ioonsel kujul ümber:
4Н + + 4Сl - + МnО 2 = Сl 2 + Мn 2 + + 2Сl - + 2Н 2 О
ja pärast identsete ioonide tühistamist võrrandi mõlemal küljel saame
4Н + + 2Сl - + МnО 2 = Сl 2 + Мn 2 + + 2Н 2 О
Reaktsioonivõrrandi koostamine vesiniksulfiidi interaktsiooniks hapendatud kaaliumpermanganaadi lahusega.
Kirjutame reaktsiooniskeemi - alg- ja saadud ainete valemid:
Н 2 S + КМnO 4 + Н 2 SO 4 → S + МnSО 4 + К 2 SO 4 + Н 2 О
Seejärel näitame aatomite oksüdatsiooniastmete muutumist enne ja pärast reaktsiooni:
Väävli ja mangaani aatomite oksüdatsiooniastmed muutuvad (H 2 S on redutseerija, KMnO 4 on oksüdeeriv aine). Koostame elektroonilisi võrrandeid, s.t. kujutame elektronide tagasilöögi ja kinnitumise protsesse:
Ja lõpuks leiame oksüdeerija ja redutseerija ning seejärel teiste reagentide koefitsiendid. Elektroonilistest võrranditest on näha, et on vaja võtta 5 mol Н 2 S ja 2 mol КМnО 4, siis saame 5 mol S aatomit ja 2 mol МnSО 4. Lisaks leiame võrrandi vasakul ja paremal küljel olevate aatomite võrdlemisel, et moodustub ka 1 mol K 2 SO 4 ja 8 mol vett. Lõplik reaktsioonivõrrand saab olema
5Н 2 S + 2КМnО 4 + ЗН 2 SO 4 = 5S + 2МnSО 4 + К 2 SO 4 + 8Н 2 О
Võrrandi kirjutamise õigsust kinnitab ühe elemendi aatomite, näiteks hapniku, lugemine; neist vasakul 2 4 + 3 4 = 20 ja paremal 2 4 + 4 + 8 = 20.
Kirjutame võrrandi ioonses vormis ümber:
5H 2 S + 2MnO 4 - + 6H + = 5S + 2Mn 2+ + 8H 2O
On teada, et õigesti kirjutatud reaktsioonivõrrand väljendab ainete massi jäävuse seadust. Seetõttu peab samade aatomite arv lähte- ja reaktsioonisaadustes olema sama. Ka tasud tuleb säilitada. Lähteainete laengute summa peab alati olema võrdne reaktsioonisaaduste laengute summaga.
Elektroonioonide tasakaalustamise meetod on mitmekülgsem kui elektrooniline tasakaalumeetod ja sellel on vaieldamatu eelis koefitsientide valimisel paljudes redoksreaktsioonides, eriti orgaaniliste ühendite osavõtul, kusjuures isegi oksüdatsiooniastmete määramise protseduur on väga keeruline.
OVR klassifikatsioon
Redoksreaktsioone on kolme peamist tüüpi:
1) Molekulidevahelise oksüdatsiooni-redutseerimise reaktsioonid
(kui oksüdeerija ja redutseerija on erinevad ained);
2) Ebaproportsionaalsuse reaktsioonid
(kui sama aine võib olla oksüdeerija ja redutseerija);
3) Intramolekulaarse oksüdatsiooni-redutseerimise reaktsioonid
(kui üks osa molekulist toimib oksüdeerijana ja teine redutseerijana).>
Vaatleme kolme tüüpi reaktsioonide näiteid.
1. Molekulidevahelise oksüdatsiooni-redutseerimise reaktsioonid on kõik reaktsioonid, mida me selles lõigus juba käsitlesime.
Vaatleme mõnevõrra keerukamat juhtumit, kui kõiki oksüdeerijaid ei saa reaktsioonis tarbida, kuna osa sellest on seotud tavalise - mitte -redoksvahetusreaktsiooniga:
Cu 0 + H + N + 5 O 3 -2 = Cu +2 (N + 5 O 3 -2) 2 + N + 2 -2 -2 + H 2 O
Osa NO 3 osakestest - osaleb reaktsioonis oksüdeerijana, andes lämmastikoksiidi NO, ja osa NO 3 ioone - muutumatul kujul - läheb vaskühendisse Cu (NO 3) 2. Koostame elektroonilise saldo:
Cu 0 - 2e- = Cu +2
N +5 +3e- = N +2
Paneme vase jaoks leitud koefitsiendi 3 Cu ja Cu (NO 3) 2 ette. Kuid koefitsient 2 tuleks panna ainult NO ette, sest kogu selles sisalduv lämmastik osales redoksreaktsioonis. Oleks viga panna tegur 2 HNO 3 ette, sest see aine sisaldab ka neid lämmastikuaatomeid, mis ei osale oksüdeerumisel ja on osa tootest Cu (NO 3) 2 (NO 3 osakesed) - siin nimetatakse seda mõnikord "ioon -vaatlejaks").
Ülejäänud koefitsiendid valitakse ilma raskusteta, kasutades juba leitud:
3 Cu + 8HNO 3 = 3 Cu (NO 3) 2 + 2 NO + 4H 2O
2. Disproportsioonireaktsioonid tekivad siis, kui sama aine molekulid on võimelised üksteist oksüdeerima ja redutseerima. See muutub võimalikuks, kui aine sisaldab mõne elemendi aatomeid oksüdatsiooni vahepealses olekus.
Seetõttu on oksüdatsiooniaste võimeline nii vähenema kui ka suurenema. Näiteks:
HN +3 O 2 = HN +5 O 3 +N +2 + +H 2 O
Seda reaktsiooni võib pidada reaktsiooniks HNO 2 ja HNO 2 kui oksüdeeriva ja redutseeriva aine vahel ning kasutada saab elektroonilise tasakaalustamise meetodit:
HN +3 O 2 +HN +3 0 2 = HN +5 O 3 +N +2 O +H 2 O
N +3 - 2e- = N +5
N +3 +e- = N +2
Saame võrrandi:
2HNO2 + 1HNO2 = 1HNO3 + 2NO + H20
Või lisage HNO 2 moolid kokku:
3HNO2 = HNO3 + 2NO + H20
Intramolekulaarsed oksüdatsiooni-redutseerimise reaktsioonid toimuvad siis, kui molekulis on kõrvuti oksüdeerivad ja redutseerivad aatomid. Mõelge Bertholleti soola KClO 3 lagunemisele kuumutamisel:
KCl +5 O 3 -2 = KCl - + O 2 0
See võrrand järgib ka elektroonilise tasakaalu nõuet:
Cl +5 + 6e- = Cl -
2O -2 - 2e- = O 2 0
Siin tekib raskus - milline kahest leitud koefitsiendist KClO 3 ette panna - lõppude lõpuks sisaldab see molekul nii oksüdeerivat kui ka redutseerivat ainet?
Sellistel juhtudel paigutatakse leitud koefitsiendid toodete ette:
KClO 3 = 2KCl + 3O 2
Nüüd on selge, et KClO 3 ette tuleb panna tegur 2.
2KClO 3 = 2KCl + 3O 2
Bertholleti soola molekulidevahelist lagunemisreaktsiooni kuumutamisel kasutatakse laboris hapniku saamiseks.
Poolreaktsiooni meetod

Nagu nimigi ütleb, põhineb see meetod ioonvõrrandite ettevalmistamisel oksüdatsiooniprotsessi ja redutseerimisprotsessi jaoks ning võtab need seejärel kokku üldvõrrandiks.
Näitena koostame sama reaktsiooni võrrandi, mida kasutati elektroonilise tasakaalu meetodi selgitamiseks.
Kui vesiniksulfiid H 2 S lastakse läbi kaaliumpermanganaadi KMnO 4 hapestatud lahuse, kaob karmiinpunane värv ja lahus muutub häguseks.
Kogemused näitavad, et lahuse hägusus tekib elementaarse väävli moodustumise tagajärjel, s.t. protsessi käik:
H 2 S → S + 2H +
See skeem võrdub aatomite arvu järgi. Laengute arvu võrdsustamiseks tuleb vooluahela vasakult küljelt lahutada kaks elektroni, mille järel saab noole asendada võrdusmärgiga:
H2S - 2e - = S + 2H +
See on esimene poolreaktsioon - redutseerija N 2 S oksüdeerumisprotsess.
Lahuse värvimuutus on seotud MnO 4 -iooni (sellel on karmiinpunane värv) üleminekuga Mn 2+ iooniks (peaaegu värvitu ja ainult kõrgel kontsentratsioonil on kergelt roosa värv), mida saab väljendada skeem
MnO 4 - → Mn 2+
Happelises lahuses moodustab hapnik, mis on osa MnO 4 ioonidest, koos vesinikioonidega lõpuks vesi. Seetõttu kirjutame üleminekuprotsessi järgmiselt:
MnO4 - + 8H + → Mn2+ + 4H20
Noole asendamiseks võrdusmärgiga tuleb ka laengud võrdsustada. Kuna esialgsetel ainetel on seitse positiivset laengut (7+) ja lõplikel on kaks positiivset (2+), siis laengute säilitamise tingimuse täitmiseks on vaja lisada vasakule pool elektroni. ahel:
MnO4 - + 8H + + 5e - = Mn2+ + 4H 2O
See on teine poolreaktsioon - oksüdeeriva aine redutseerimise protsess, s.t. permanganaatioon
Üldise reaktsioonivõrrandi koostamiseks on vaja lisada poolreaktsiooni võrrandid tähtaegade kaupa, olles eelnevalt võrdsustanud antud ja vastuvõetud elektronide arvu. Sellisel juhul määratakse vastavalt väikseima kordaja leidmise reeglitele vastavad tegurid, millega poolreaktsioonide võrrandid korrutatakse. Lühidalt öeldes toimub salvestamine järgmiselt:

Ja kui oleme vähendanud 10H +, saame lõpuks
5Н 2 S + 2MnO 4 - + 6H + = 5S + 2Mn 2+ + 8Н 2 О
Kontrollime ioonilisel kujul koostatud võrrandi õigsust: hapniku aatomite arv vasakus osas on 8, paremas osas 8; laengute arv: vasakul (2 -)+(6+) = 4+, paremal 2 (2+) = 4+. Võrrand on õige, kuna aatomid ja laengud on võrdsed.
Poolreaktsioonide meetodil koostatakse reaktsioonivõrrand ioonsel kujul. Sellest molekulaarsel kujul võrrandile üleminekuks toimime järgmiselt: ioonvõrrandi vasakul küljel valime igale anioonile vastava katiooni ja igale katioonile - aniooni. Seejärel kirjutame võrrandi paremasse serva samad ioonid sama arvu, mille järel ühendame ioonid molekulideks:

Seega, poolreaktsiooni meetodi abil redoksreaktsioonide võrrandite koostamine annab sama tulemuse nagu elektroonilise tasakaalu meetod.
Võrdleme mõlemat meetodit. Poolreaktsioonide meetodi eelis võrreldes elektroonilise tasakaalu meetodiga on see. et see kasutab mitte hüpoteetilisi ioone, vaid tegelikult olemasolevaid. Tõepoolest, lahuses ei ole ioone, kuid ioone on.
Poolreaktsiooni meetodi puhul ei pea te teadma aatomite oksüdatsiooni olekut.
Üksikute iooniliste poolreaktsioonivõrrandite kirjutamine on vajalik galvaanilise elemendi keemiliste protsesside mõistmiseks ja elektrolüüsi ajal. Selle meetodi puhul on nähtav keskkonna roll kogu protsessis aktiivse osalejana. Lõpuks, poolreaktsiooni meetodi kasutamisel ei ole vaja teada kõiki saadud aineid, need ilmuvad reaktsiooni võrrandis selle tuletamisel. Seetõttu tuleks eelistada poolreaktsioonide meetodit ja seda tuleks kasutada kõigi vesilahustes toimuvate redoksreaktsioonide võrrandite koostamisel.